

当前位置:首页 > 公司新闻

● 发表期刊: Horticulture Research
● 影响因子:3.850(农林1区)
● 发表时间:2020年6月
研究背景
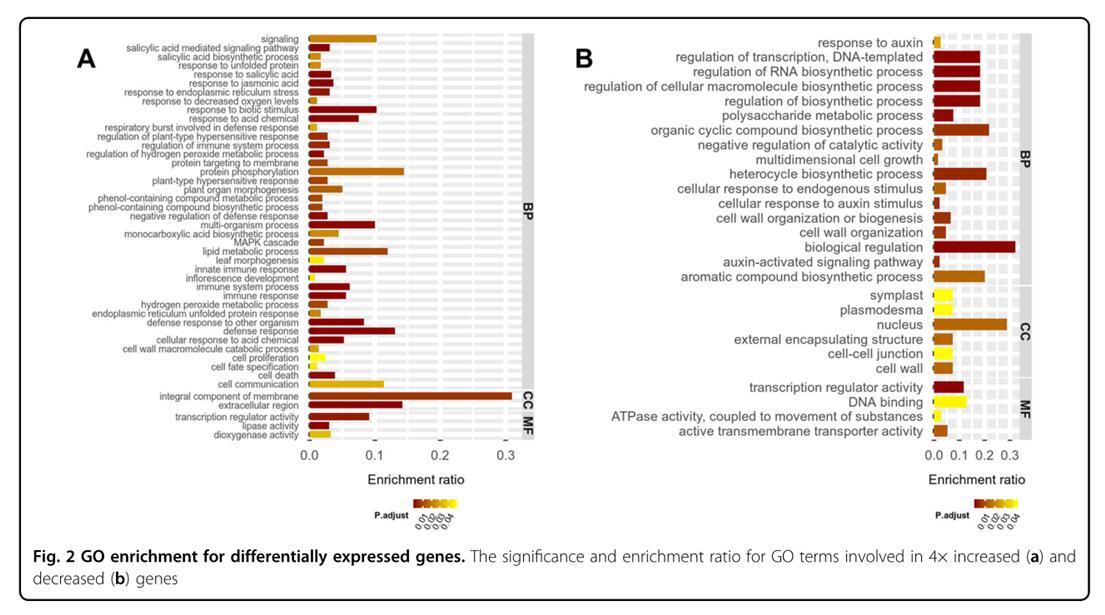
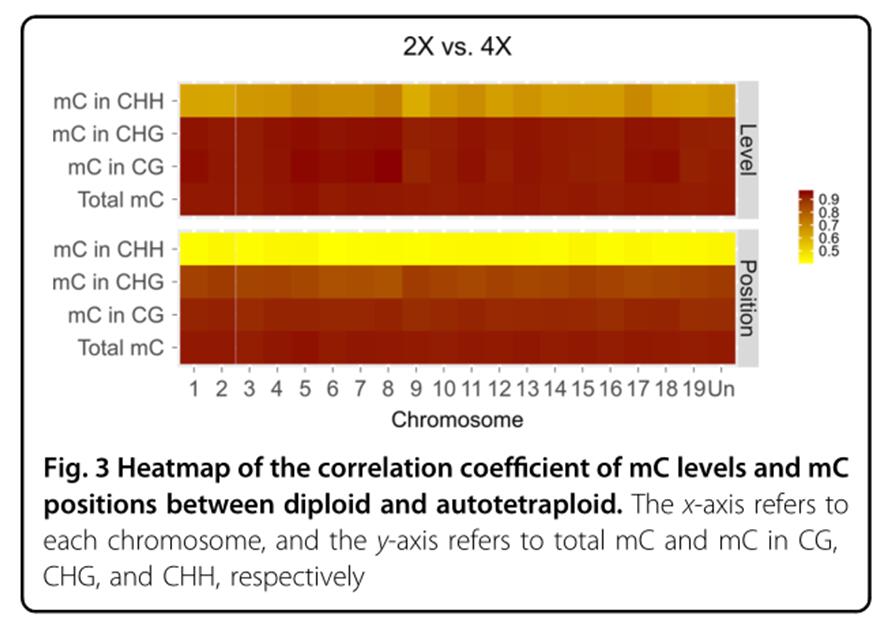
多倍体或全基因组复制(WGD)是植物进化的主要驱动力之一,与二倍体相比,人工多倍体通常在形态上表现出很多变异,可作为宝贵的育种材料。植物修剪对于维持产量,确保营养/生殖生长平衡以及最大化果实品质至关重要。在植物器官脱落过程中,离层区(AZ)是自剪所必需的,植物激素平衡对植物器官脱落有重要作用,乙烯引发AZ的形成,生长素抑制植物器官脱落,生长素下降会增加乙烯反应,随后促进AZ分化;乙烯增加ACC氧化酶(ACO)基因的表达和ACO活性,抑制生长素运输。诱导多倍体通常会发生基因组结构和表观遗传变异,目前很少有研究人工多倍体表观遗传变异与基因表达变化之间的关系。本研究中,秋水仙碱诱导的同源四倍体葡萄表现出侧枝生长减少和自剪现象,作者通过RNA-Seq和WGBS技术检测DNA甲基化变化及其在基因表达修饰和自我修剪中的作用,为葡萄育种和生产提供理论指导。 “京焰晶”(2×)葡萄是典型的二倍体品种。2×的分支能继续生长,其腋芽在生长季节又长出新的分支(图1A)。与2×相比,同源四倍体(4×)超过80%腋芽没有长出,或由于尖端脱落而不会长出完整分支,而且4×的顶芽会停止生长,然后从绿色变为黄色,逐渐变成棕色并消失(图1C)。因此2×和4×葡萄的芽生长存在明显差异。 对2×和4×进行RNA-seq,同2×相比,4×有572个下调基因,594个上调基因。上调基因显著富集在49个GO terms,大部分上调基因主要与生物胁迫反应(如干旱)和非生物胁迫反应(如真菌侵袭)有关(图2A);而下调基因显著富集在33个GO terms,主要与生物代谢,生物合成有关,另外还与转录调控,基因表达和RNA代谢,含氮化合物代谢,大分子生物合成和细胞代谢的调节有关(图2B)。 对2×和4×葡萄尖分别进行WGBS,3种环境下,CHH环境的甲基化胞嘧啶位点最多,2×和4×甲基化胞嘧啶位点百分比分别为16.5%和15.57%;其次是CG环境,2×和4×的mCG百分比分别为34.21%和33.42%;CHG环境中甲基化胞嘧啶位点数量最少,但mCHG百分比均高于30%。另外,2×和4×葡萄在不同环境下的甲基化水平显著相关 (R 2 > 0.99),说明同源四倍体葡萄的DNA甲基化是高度保守的。2×和4× mC的总甲基化水平都达到7%。mCG平均甲基化水平最高,达到3.5%;其次是mCHG,平均甲基化水平达到3%;而mCHH平均甲基化水平最低,低于1.5%。 就甲基化水平和甲基化位置而言,2×和4×的甲基化胞嘧啶mCs 高度相关 (R 2 >0.9)。CG和CHG环境2×和4×的mCs均高度相关,其中CG环境的2×和4×相关系数大于0.9,CHG环境的相关系数在0.85-0.9之间。但是,CHH环境的mCs并不相关(图3)。说明在单碱基水平上,总mCs,mCHG和 mCG的甲基化位置和甲基化水平是高度保守的。 同2×相比,4×总甲基化水平上升的mCs方差贡献率(24.6%)大于降低的mCs(22.3%)。三种环境下,mCHH甲基化水平变化最大,甲基化水平上升和降低的mCHH方差贡献率分别为10%和8.89%,且甲基化水平差异倍数(Fold change)大于2的mCHH方差贡献率超过了2%。CHG环境中,甲基化水平上升和降低的mCHG方差贡献率分别为7.42%和6.87%,甲基化水平差异倍数大于2的mCHG方差贡献率均约为1%。mCG甲基化水平变化最小,甲基化水平升高和降低的mCG方差贡献率分别为7.1%和6.5%,甲基化水平升高和降低倍数大于2的mCG方差贡献率只有0.36%和0.3%。可见2×和4×之间的甲基化组存在较大变异。 在2×和4×之间共鉴定到1.14×10 5个DMRs(差异甲基化区域),其中CG和CHG环境分别只有41个和6个,表明在全基因组复制过程中,CG和CHG环境DNA甲基化的稳定性。其中位于基因区域的DMRs占比55.3%。同源四倍体(4×)中DMR相关的上调基因,下调基因,无差异基因,不表达基因占比分别为67.51%、66.96%、70.65%和56.19%。 基因体区DMRs甲基化水平与基因表达水平呈负相关 根据DMRs类型,将基因分为四组:高甲基化DMRs相关基因,低甲基化DMRs相关基因,高低甲基化DMR相关基因,无DMR基因,且这四类基因表现出相似的表达模式。与其它3种类型基因相比,在4×上调基因中,基因体区域的低甲基化DMR相关基因的差异倍数(fold change)最大;而在下调基因中,基因体区域的高甲基化DMR相关基因的差异倍数最大。表明在葡萄基因组复制过程中,基因体区域DMRs与基因表达呈负相关。此外,在上游区,下游区和整个基因中,四种类型基因的差异倍数没有区别(图4)。 在4×中,基因体区包含低甲基化或高甲基化DMRs的12个基因表达分别上调或下调4倍以上。其中3个下调基因中,2个基因同时包含高甲基化DMR和低甲基化DMR,1个基因仅包含高甲基化DMR。另外9个上调基因中,6个仅包含低甲基化DMRs,其他3个同时包含低甲基化DMRs和高甲基化DMRs。比如,低甲基化DMR相关基因ACC氧化酶基因(ACO1)在4×中上调表达。 4×在24小时内释放出0.016 µL / g乙烯明显高于2×(0.009 µl / g)(图5A);脱落酸(ABA)含量较高,但PA含量明显较低(图5C);而ABA降解基因CYP707A表达下调(图5D);4×的7种ABA反应基因和SnRK2均上调表达。 4×中10个乙烯反应相关基因表达上调,ROS抵抗相关基因(CAT2-1),病原体相关基因(PR-4和PR-4B),GDSL脂肪酶基因(GLIP1和GLIP2)和碱性几丁质酶基因(HCHIB)均上调表达,这些基因被报道都与乙烯反应有关。 4×组培苗与乙烯反应相关的3个ERF基因和PR-4B基因表达上调(图7);2×经乙烯处理后,这些基因上调表达(图7A);而4×经乙烯抑制剂(AVG)处理后,这些基因下调表达(图7B)。有研究表明植物自剪过程中乙烯会诱导离层区的形成,经乙烯处理后,4×的顶芽薄片和顶芽旁边的顶叶基部出现了离层区(AZs),而2×没有(图6),这可能是由于4×内源乙烯含量较高,对外源乙烯的响应阈值较低。 4×基因ACO1表达明显高于2×(图5B),ACO1基因体区域含有低甲基化DMR,基因区的DMRs与基因表达呈负相关,ACO1基因区的低甲基化DMR导致基因表达上调。同源四倍体葡萄ACO1的上调表达可能会增加乙烯释放并发生自剪,因此ACO1在4×葡萄自剪与DAN甲基化有关系。 另外,4个ABA反应基因上调,而CYP707A下调表达;乙烯处理的2×中,4个ABA基因上调,而CYP707A表达下调;相反,AVG处理的4×中,ABA反应基因下调,而CYP707A上调(图7)。已有研究表明乙烯抑制了植物生长素运输,破坏植物生长素信号通路,植物器官脱落过程中ABA活性增加,因此,乙烯的释放可能会减少ABA的降解,增加ABA含量。 4×中,3个生长素转运蛋白基因(AUX1,AVP1和PGP1)和9个生长素应答基因表达量下调,这些基因显著富集在生长素介导的信号传导途径。这9个生长素应答基因,在乙烯处理的2×中下调表达,在AVG处理的4×中上调表达(图7)。4个细胞分裂素基因(2个CYCD3基因,HAT22基因和CRF4基因)均下调表达。研究表明经乙烯处理后CKX的活性增加,细胞分裂素氧化酶基因(CKX5)在4×中显著上调,在乙烯处理2×中上调表达,而在AVG处理的4×中下调表达(图7)。




研究结论
1. 通过RNA-Seq筛出二倍体和同源四倍体葡萄之间的差异基因,同源四倍体中上调基因主要与应激反应途径有关,而下调基因主要与生物代谢和生物合成有关。
2. 利用WGBS技术绘制二倍体和同源四倍体葡萄单碱基分辨率的DNA甲基化图谱。比较二倍体和同源四倍体葡萄的甲基化组,发现CG和CHG环境的DNA甲基化较为保守。在同源四倍体的基因体区域,低甲基化DMR相关基因上调表达,高甲基化DMR相关基因下调表达。
3. 葡萄染色体同源加倍后ACO1基因区去甲基化,ACO1在同源四倍体中上调表达,致使同源四倍体表现出自剪表型。在葡萄基因体区域,低甲基化DMRs使基因表达上调,表明基因组复制过程中表观修饰变化影响基因表达。
原文链接
https://www.nature.com/articles/s41438-020-0303-7