热搜词:宏基因组测序 芯片检测

发布时间:2018-08-31 17:00:00 点击数:次
基因组编辑技术是近些年迅速发展起来的基因组定点编辑技术,特别是CRISPR-Cas9系统的基因组编辑工具近几年迅猛发展,在医疗、农业等领域已经得到广泛应用。
关于CRISPR/Cas9基因编辑系统成功产生基因编辑事件已经很多报道,今天,小编以Plant Biotechnology Journal发表的“CRISPR/Cas9-mediated efficient targeted mutagenesis in grape in the first generation”这篇文章为例来探讨基因编辑技术的实际应用。
1.西北农林科技大学果园种植的无核葡萄
2.四个sgRNA表达盒通过Golden Gateassembly构建CRISPR/Cas9载体
3.PCR扩增产物送到TSINGKE公司完成测序
1. 选择靶位点构建载体
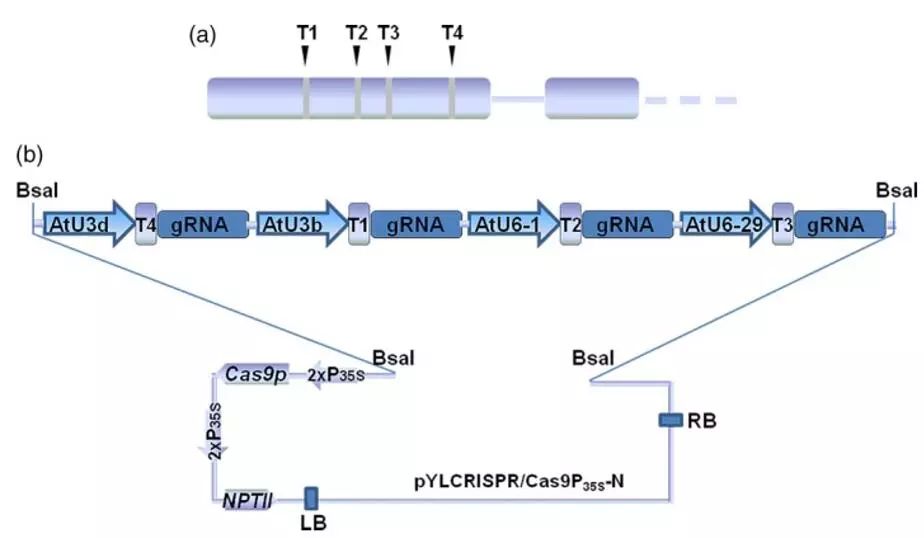
图1 选择VvWRKY52基因靶位点并构建Cas9 / sgRNA
本研究利用多靶点编辑系统,选择VvWRKY52作为靶基因,并对葡萄靶基因第一个外显子区域同时设计了4个靶位点(T1,T2,T3,T4),用BsaI酶切pYLCRISPR/Cas9P35S-N双元载体并插入四个sgRNA(图1),构建CRISPR/Cas9基因表达载体。
2.葡萄遗传转化及转基因植物的突变体鉴定
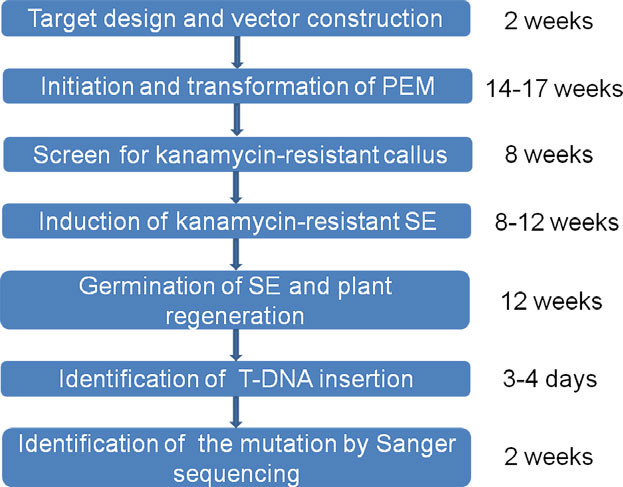
图2 葡萄中农杆菌转化法流程
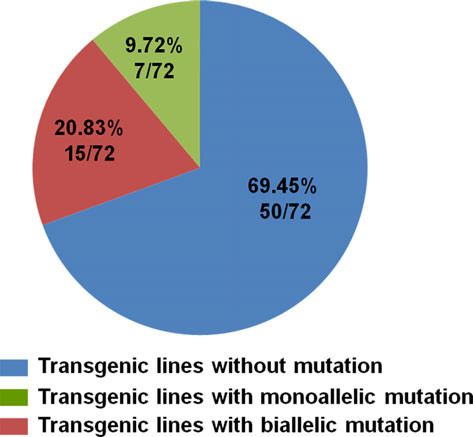
图3 CRISPR/Cas9系统在葡萄中的编辑效率
载体利用农杆菌转化法侵染葡萄原胚细胞(PEM),经卡那筛选,得到再生植株,再鉴定得到T-DNA插入的植株,最终通过测序确定发生突变(图2)。所有的T0代转基因株系中,有22株发生了突变,突变率达到30.55%(22/72)。其中双等位突变频率为20.83%(15/72),杂合突变频率为9.72%(7/72)(图3)。由此可以看出,通过CRISPR/Cas9技术可以有效地在第一代中产生葡萄的双等位突变。
3.鉴定VvWRKY52基因产生的突变
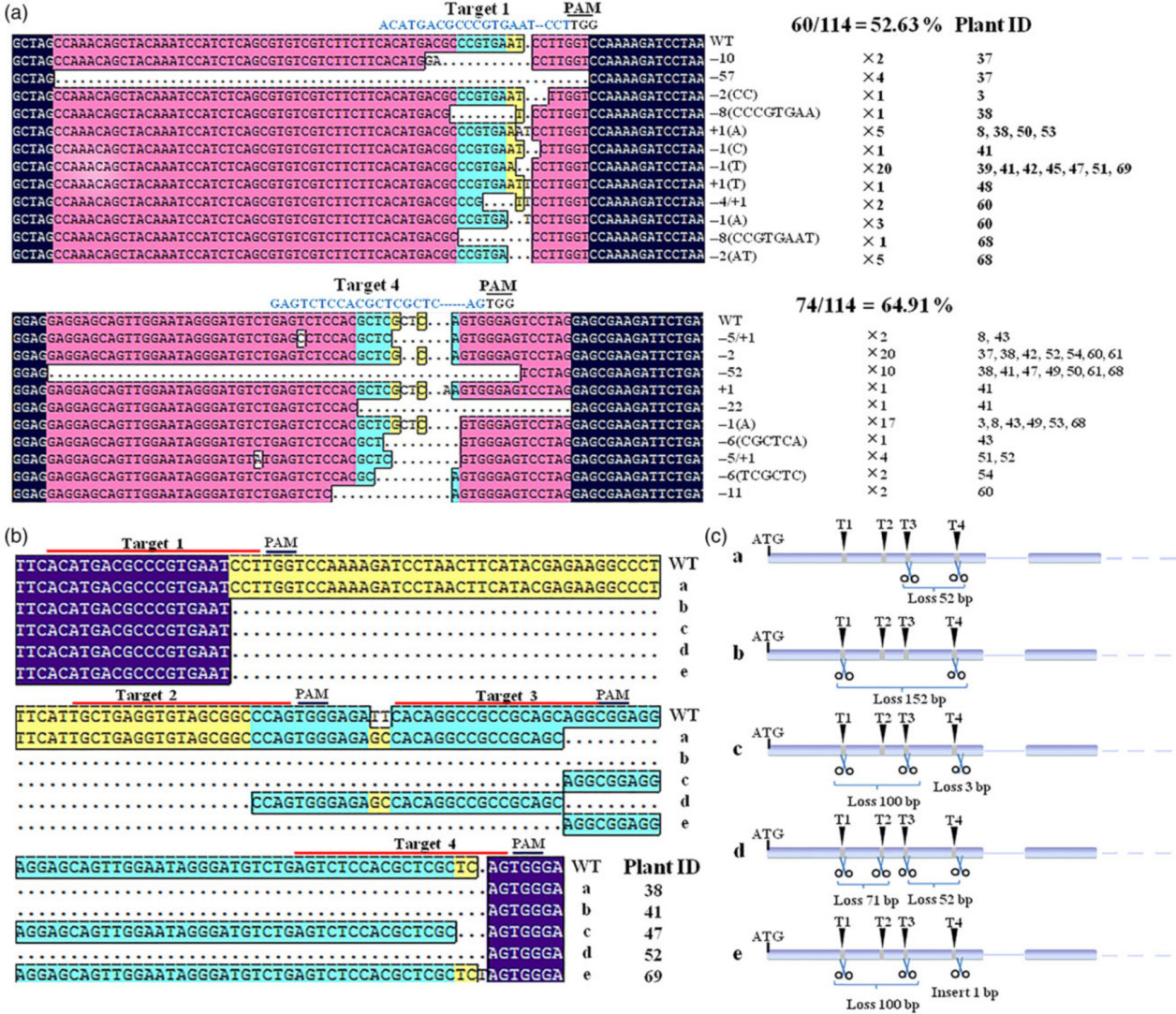
图4 CRISPR / Cas9介导的基因编辑在葡萄转基因植株产生不同突变类型
随后,进一步鉴定CRISPR / Cas9系统产生的突变类型,对22个转基因株系的114个单克隆进行测序分析。结果发现,在T4靶位点处突变效率为64.91%(74/114),在T1靶位点处突变效率为52.63(60/114),而T2和T3靶站点处的突变效率比较低。其中,T1和T4靶位点处出现了小片段的插入,小片段的缺失和大片段的缺失,同时在四个靶位点之间也出现了大片段缺失(图4b,图4c)。这表明CRISPR / Cas9系统可用于第一代葡萄中的精确基因组编辑。
4. Off-target分析
表1 T0代植株脱靶分析
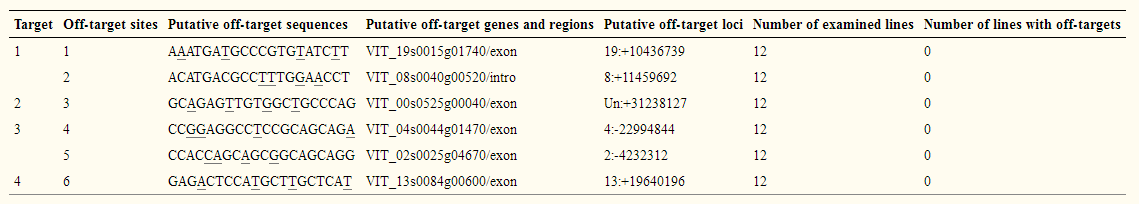
为了检测编辑位点是否存在脱靶情况,研究人员利用CRISPR-P网站预测潜在的脱靶位点,通过对四个靶点的潜在的脱靶位点进行了脱靶分析,在12个双等位基因突变的株系中均未发现脱靶现象。证明这套多靶点编辑系统在葡萄中具有很高的特异性。

图5 VvWRKY52转基因株系接种灰霉菌(Botrytis cinerea)5天后的表型
经过灰霉病接种实验发现,WRKY52突变株系比野生型株系显著提高了对灰霉菌的抗性,并且双等位基因突变株系比杂合基因突变株系具有有更强的抗性。
葡萄在世界范围内广泛种植,具有重要的经济价值,但每年受霜霉病、灰霉病等各种真菌病害的危害严重,损失巨大。利用多靶点编辑系统对T0代葡萄基因高效编辑,成功获得双等位基因突变体。应用CRISPR/Cas9技术在葡萄上建立高效的基因编辑系统,很容易获得靶标基因的突变体,对葡萄抗病基因功能研究和育种工作有重要意义。