热搜词:宏基因组测序 芯片检测

武汉博越致和生物科技有限公司
电话:027-87705460
传真:027-87705460
地址:武汉市高新大道666号光谷生物城C6栋3楼
发布时间:2018-10-17 点击数:次
蛋白质磷酸化修饰是生物体内普遍存在的调节机制,虽然细胞内约有30%的蛋白能发生磷酸化,但磷酸化修饰是一个动态过程,在特定时间及特定刺激条件下,细胞内磷酸化蛋白只占总量的1%-2%,并且对磷酸化修饰来说,其本身是一个可逆的过程,磷酸化修饰与去磷酸化修饰的转换十分快速。因此,磷酸化富集技术对于磷酸化蛋白质组学的研究尤为关键。目前,基于IMAC和TiO2的磷酸化肽段富集技术,结合高通量液相色谱质谱联用技术,成为高通量定性和定量研究蛋白质磷酸化修饰的最有效手段。
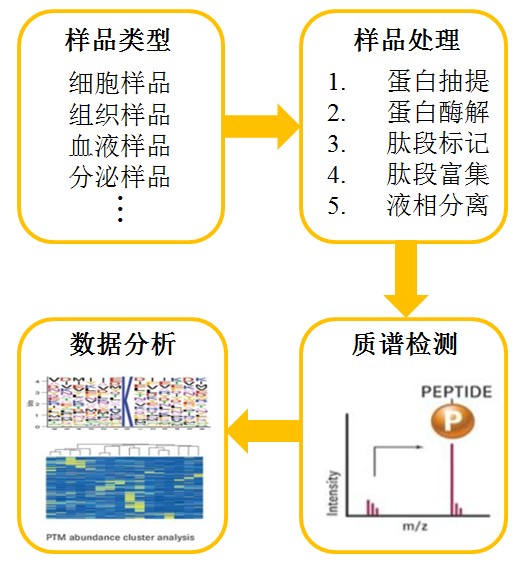

全面性:以整个细胞所有蛋白为研究对象,研究内容囊括了细胞内所有具有生命功能的蛋白
可靠性:可一次性全面检测不同蛋白激酶及磷酸化酶对同一个蛋白磷酸化程度的影响
高效性:在一次试验中考虑了各种变量,克服了经典生物学中逐步添加变量的缺陷
探索性:以细胞内所有蛋白为研究对象,更易发现未知的新磷酸化位点和磷酸化蛋白质
研究内容
本研究中,我们结合SILAC标记,IMAC富集,以及HILIC色谱分离和高通量质谱检测,对SeV感染的293T细胞进行磷酸化蛋白质组学分析。找出受SeV刺激调控的磷酸化位点,为天然免疫研究提供新线索。
研究结果
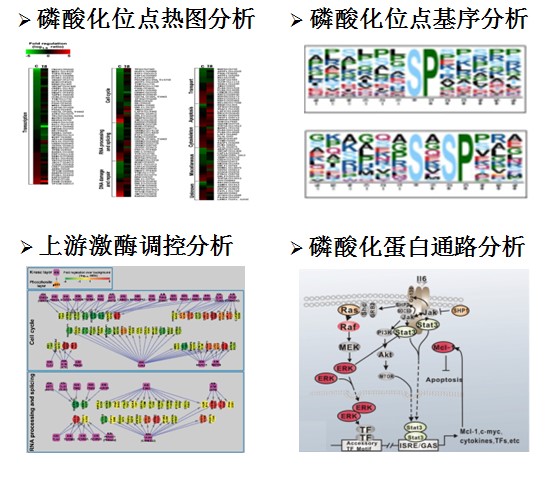
为保证数据准确性,进行了三次生物学重复,一共鉴定到5677个磷酸化肽段,其中4380个磷酸化肽段被定量到。根据皮尔森相关性分析,发现实验重复性好,数据可靠性高。随后对发生变化的蛋白磷酸化位点进行了一系列生物信息学分析,结果如下:
The SCX/IMAC enrichment approach for global phosphorylation analysis by mass spectrometry. Nature Protocols 2008.
High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nature Biotechnology 2015.
