热搜词:宏基因组测序 芯片检测

发布时间:2020-06-19 14:00:00 点击数:次
· 发表期刊:Plant Biotechnology Journal
· 发表时间:2019.08.01
· 应用技术:GWAS;RNA-seq
· 影响因子:6.84
研究背景
油菜籽的产量主要由三个组成部分决定,即:长角果数,单个长角果的种子数及种子重量,其中长角果数与产量是高度相关。而且提高长角果数对提高油菜籽的产量至关重要。在油菜种质资源中,长角果数普遍存在变异性,这对油菜产量的研究和改良具有十分重要的意义。
作为典型的数量性状,长角果数容易受到环境条件的影响,且具有中度遗传率。在油菜籽中,长角果数量的研究主要集中在QTL定位上。迄今为止,已经报道了90多个基因座位点,这些位点分布在19个连锁组中的18个上(不包括C07)。由于几乎所有的长角数量QTL都显示出中度作用,且易受环境影响,因此很难通过基于图的克隆来鉴别基础基因。在模型植物拟南芥中,已鉴定出数十种基因可通过调节花序数量来影响长角果数(如WUS、CLV3和AP)。还鉴定到水稻FON1,FON2,FON4基因、番茄中SFT基因和玉米BIF2基因调节花器官数量。此外,还发现了几种调节角果、花数量的途径及机制。但是,大多数这些基因是通过突变分析确定的,不能解释一般的自然变异。
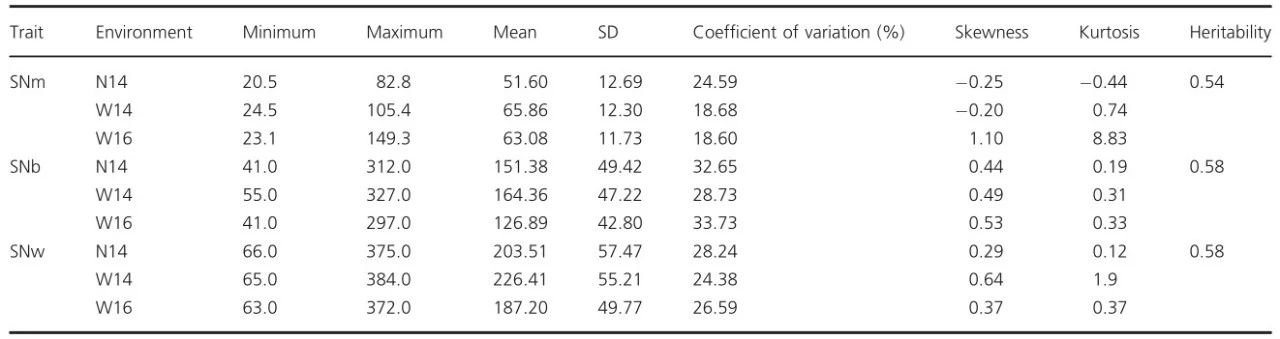
1. GWAS分析 花序(SNm),分支花序(SNb)和整株植物(SNw)是影响角果数的3个主要表型性状,我们对生长在三种不同环境331个材料进行研究(N14,2014 种植南昌;W14,2014 种植武汉;W16 , 2016种植武汉)。在这三个环境中,SNm从20.5变化到149.3,变化范围为4.0至6.5倍;SNb 从41变化到327,变化范围为5.9 至7.6倍;SNw从63到384不等,变化范围为5.6 到5.9倍(图1,表1)。这三个性状的遗传力分别为0.54、0.58 和0.58,此结果与之前报道的遗传力值高度一致。SNm和SNw,SNb和SNw,SNm和SNb的Pearson相关系数分别为0.562**,0.969 **和0.385**。这表明SNw主要由SNb决定,其次是SNm。SNm和SNb之间的低相关性反映了SNb受分支数影响的两个性状的不同遗传调控。
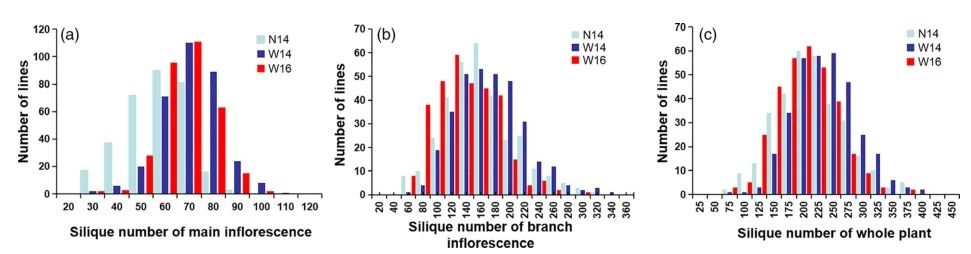
图1 三种环境中角度数的变化情况
表1 不同环境中SNm,SNb和SNw的表型变异
使用GLM模型进行GWAS分析。总共鉴定出191个显着相关的SNP,其中75、88和104分别来自SNm,SNb和SNw。在这些相关的SNP中,分别在N14,W14和W16中鉴定出22、111和16;在三种环境中使用BLUP值鉴定到62个SNP(图2)。
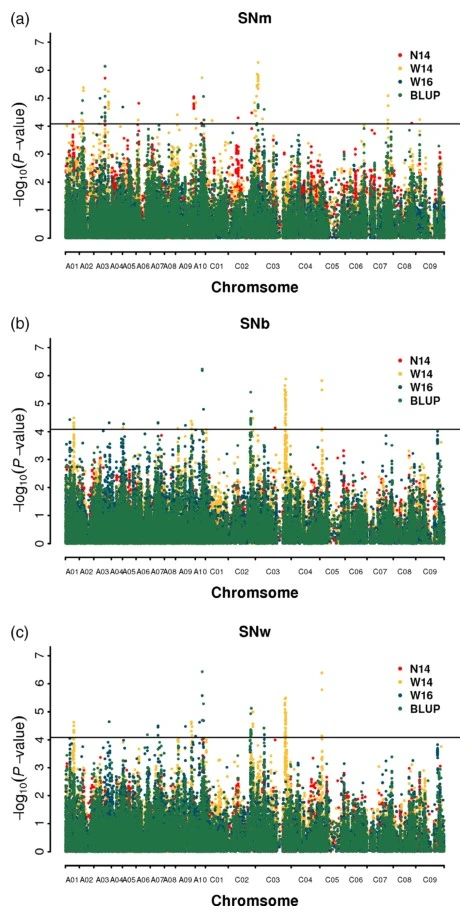
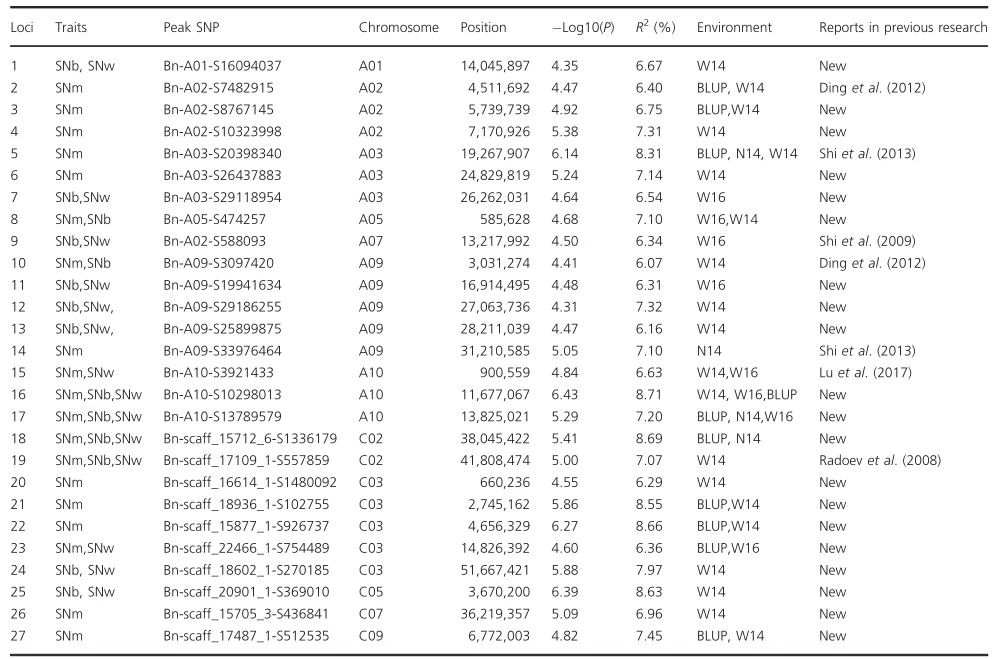
作者使用之前报道的方法对重要的群集SNP位点进行整合。若前后SNP在500kb以内或LD统计量r2>0.2,则认为SNP是同一基因座。结果,所有191个显着相关的SNP被合并为47个基因座。其中27个位点具有超过一个SNPs,这意味着结果的高可靠性并可用于进一步分析。这些基因座分布在19个油菜的12个染色体中(不包括A04,A06,A08,A11,C04,C06和C08),结果表明表型变异范围是5.60%至8.71%(表2)。值得注意的是,可以在不同的环境中重复识别12个(44.4%)的基因座,其中两个环境中有9个基因座,而三个环境中(包括BLUP)中有3个基因座。此外,两个已识别的基因座同时与SNm和SNw相关联,其中八个基因座与SNb和SNw同时鉴定,四个与SNm,SNb和SNw同时鉴定。所有这些基因座说明了SNm,SNb和SNw的总表型方差分别为31.93%,25.95%和31.46%。这些结果表明,长角果数在遗传上是一种复杂的特征,且易受环境影响,这与其他研究一致。
在先前的研究中,已经报道了超过90个基因座位点,这些位点分布在19个连锁组中的18个连锁组上(不包括C07)。作者为了检验和其他研究中检测到的多角形基因位点的位置关系,基于Darmor_V4.1的物理图谱进行了比较分析。在检测到的27个基因座中,有7个基因座分别与先前研究中报道的基因座重叠,而在我们的研究中检测到的大多数基因座是之前没有发表的(表2)。
表2 GWAS生成的曼哈顿图结果得出主要花序的长角果数
2. 油菜角果数变异的生理基础
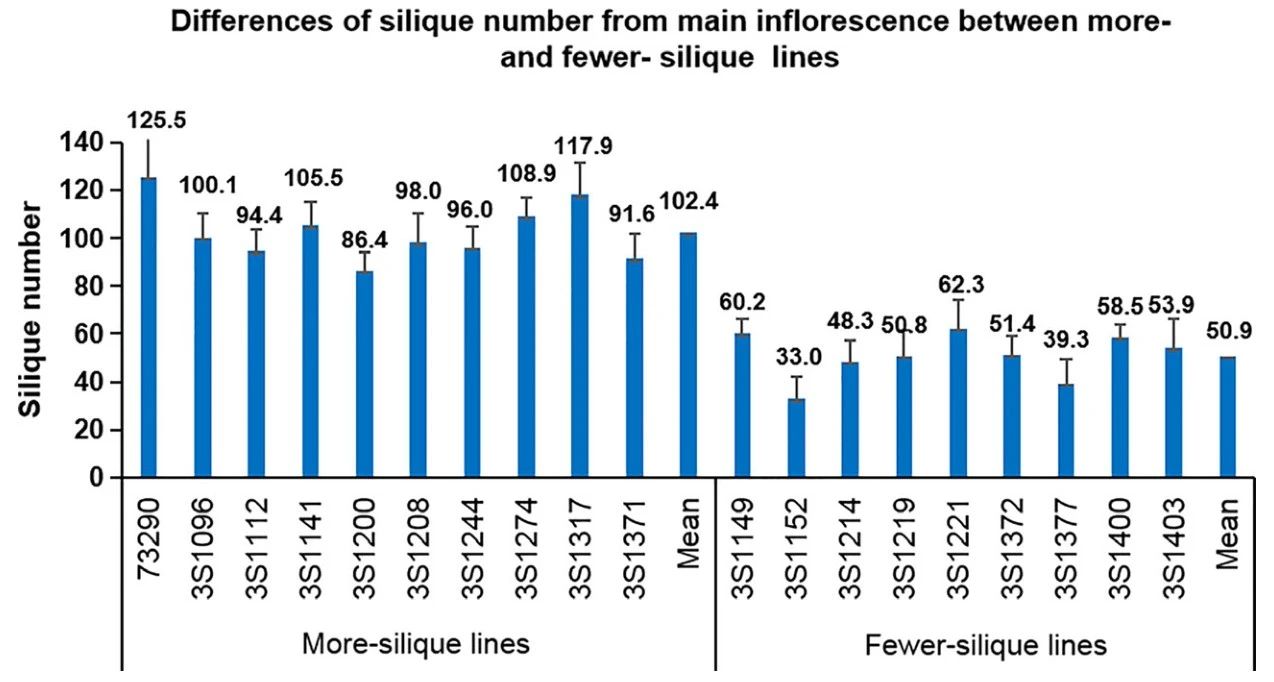
为了了解油菜中长角果数量变化的生理基础,我们从相关种群中选择了一批极端品系进行进一步研究。超过10个角果数和少于9个角果数的SNm变化范围分别是从86.4至125.5和33.0至62.3,并且前者的平均值(102.4)显着大于后者的(50.9)(P<0.01)(图3)。为了减少工作量,生理研究中提到的花和角果数量均来自主要花序。
3. 角果数变化是由花数和角果定型率共同引起
为了弄清两个因素对油菜中长角果数变化的相对影响,调查了两种类型的极端系的花数和长角果定型率(长角果数/花数),并进行了比较。如预期的那样,花朵数和角果树定型率都与角果数高度相关,Pearson相关系数分别为0.84**和0.71**(图4)。
多角果系和少角果系的花数范围分别是108.3至199.9和74.6至102.7,并且前者的平均值(131.0)显着高于后者的平均值(86.7)(P<0.01)(图4)。多生系和少生系的生果率分别从62.8%至89.7%和从43.4%至80.7%,前者的平均值(79.4%)也显着高于(59.5%)后者(P<0.01)(图4)。多角果系的花序数和落角率分别比少角果树线高51.1%和33.4%。此外,统计分析表明,多系和少系之间的长角果数差异是由于花数和长角果定植率的累积差异所致,分别占75.2%和24.8%。
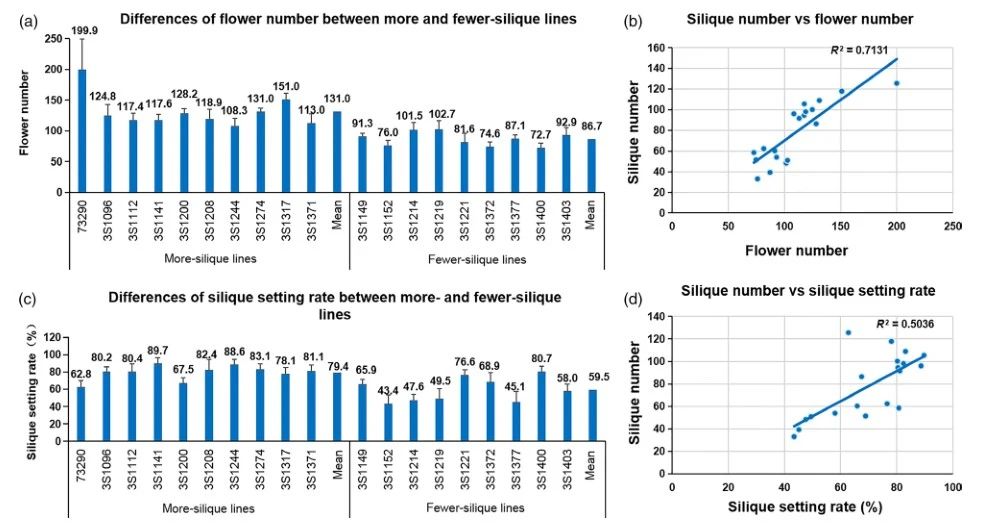
图4 角果数变化是由花数和角果定型率共同引起
4. 角果数与总光合作用高度相关
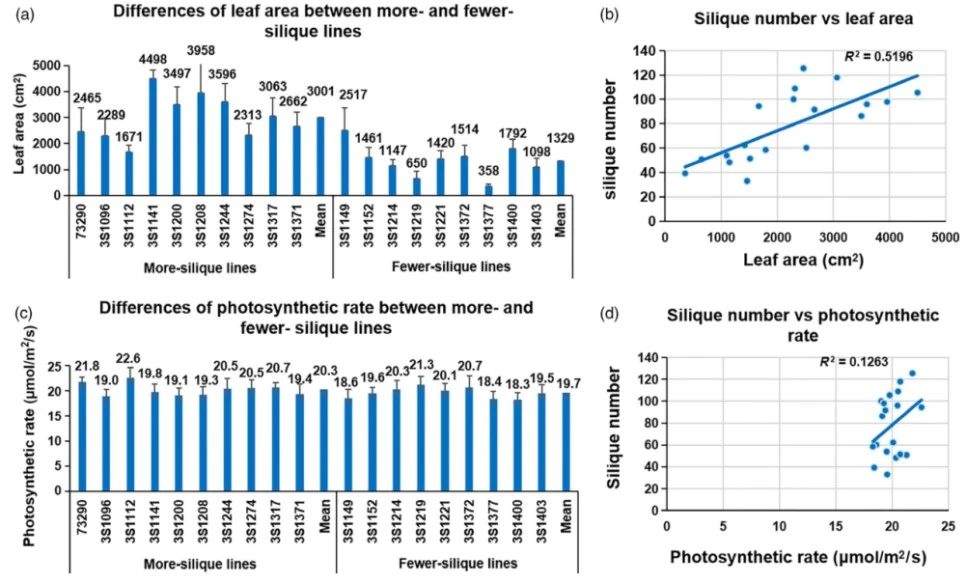
植物生长和发育一系列活动(包括花芽分化)所需的能量和有机物的来源均来自光合作用。在IM分化和开花期,叶片是最重要的光合作用器官。为了研究叶片光合作用在两种类型的长角果数差异形成中的作用,我们测量了极端情况的初花期,植物快速生长之前以及IM分化的花卉原基不能形成有效的花/长角果时的光合速率和叶面积。结果表明,多长角果系和少长角果系的叶片光合速率分别为19.0至22.6和18.3至21.3lmol/m2/,并且两种类型的平均值(20.3和19.7lmol/m2/s)相似(P<0.01)(图5)。但是,长角果系的总叶面积(1671-4498cm2)显着大于少角果系的总叶面积(358-1792cm2),前者的平均值(3001cm2)为125.8%。大于后者的(1329cm2)(P<0.01**),因此,多角果系的总叶片光合作用比少角果系(P<0.01**)大132.7%(图5)。这些结果表明总光合作用在确定角果数量中的起重要作用。
5. 角果数与生物量高度相关
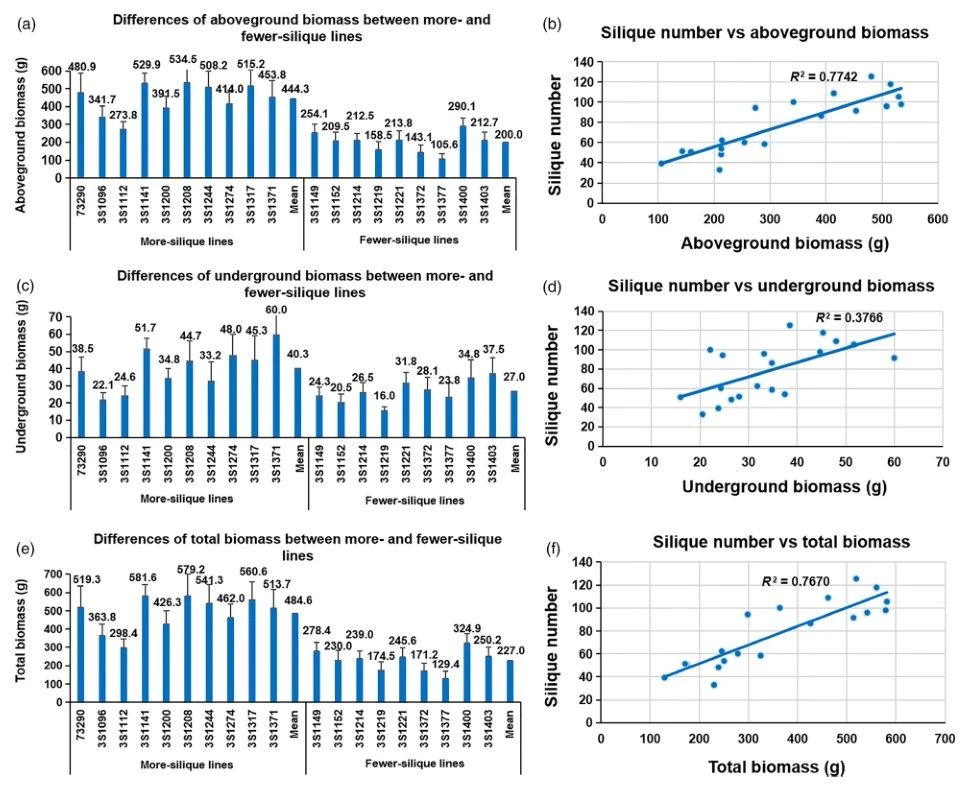
光合作用越强产生的同化物越多,同时这些同化物促进了生物量的积累和花/长角果的形成。为了验证该假设,作者对初始开花时的生物量进行测量。多生角果系的地上生物量,地下生物量和总生物量分别从273.8g至534.5g,22.1g至60.0g和298.4g至581.6g不等(图6)。少生角果系的地上生物量,地下和总生物量分别从105.6g至290.1g,从16.0 g至37.5 g和从129.4g至324.9g不等(图6)。显然,多生长角果系的平均地上生物量,地下生物量和总生物量(444.3g,40.3g和484.6g)均显着高于少生长角果系的平均生物量(200.0g,27.0g和227.0g),比例为分别为122.2%和49.3%和113.5%(图6)。生物量和长角果数的Pearson相关系数显示是高度相关(0.88**(地上),0.61**(地下)和0.88**(总生物量))(图6)。结果证实,更多的生物量积累(来自叶片的光合作用)促进了油菜中长角果的形成。

7. RNA-seq 比较分析
为了分析在转录组水平上多生和更少生的长角果系花数差异的分子机制,使用两组对比池的茎尖分生组织(SAM)进行了转录组测序,设计三个生物学重复。为了验证RNA-seq结果,作者进行了qRT-PCR验证。这些选定基因中基于RT-PCR的表达模式的趋势与RNA-seq的方法检测到数据趋势一致。
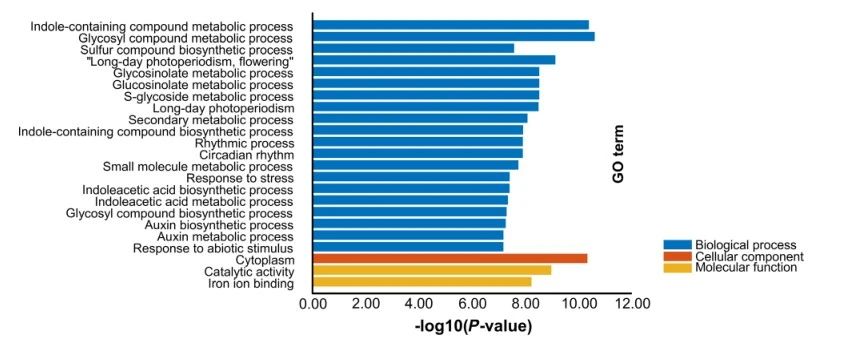
总共鉴定出2746个差异表达基因(DEG),其中上调基因数为1422个,下调基因数为1324个,使用TBtools软件将差异基因进行GO功能富集分析。在top23的GO Term中(校正后的P值<1.0E-5),有6个是生长素相关的生物合成/代谢生物学过程,如吲哚乙酸的生物合成/代谢过程和生长素的生物合成/代谢过程(图8),表明生长素在IM分化过程中的起重要作用。应当指出的是,除了植物生长素外,其他种类丰富的营养素还通过促进营养合成,光周期/昼夜节律调节和改善植物综合抗性而与营养生长密切相关。它们是长时间的光周期开花,长时间的光周期,节律性过程,昼夜节律,硫化合物生物合成过程,对压力的反应和对非生物刺激的反应(图8)。这些结果为深入了解油菜中长角果数量变化的分子机制提供了进一步的见解:良好的营养生长可以在很大程度上决定长角果数量的顶端分生组织分化能力。
总共142个DEG位于27个基因座的区域,其中101个DEG(71.1%)与拟南芥基因具有显着同源性并具有功能注释。参照拟南芥同源注释,鉴定出位于重要基因座的六个DEG作为候选基因,它们是BnaA02g08800D,BnaA02g08900D,BnaA05g01050D,BnaA09g05170D,BnaA10g00780D和BnaA10g14470D,分布在A02,A05,A09和A10上。已知6个DEG通过影响IM分生组织的活动、花器官的发育、叶片的膨大或生物量的积累来调节花的数量。研究还表明,对GWAS和RNA-seq进行整合分析可能是在长角基因位点内鉴定候选基因一种有效的方法。
角果数是油菜产量中最重要的组成部分。为了剖析油菜种质中角果数量自然变化的机理,进行了一系列研究。对331个油菜样品进行了全基因组关联分析(GWAS),定位到27个基因座(包括20个新的基因座)。更多和更少的种系之间的种群数差异可归因于累积差异花数和角果树定型率。他们分别占75.2%和24.8%。角果数与总光合作用和生物量高度相关。显微分析表明,多长角果系和少长角果系之间的差异通常发生在花蕾的数量上,而不是形态。茎顶分生组织(SAM)的转录组分析表明,大多数富集群体与生长素的生物合成/代谢,营养生长和营养/能量积累有关。通过整合GWAS和RNA-seq结果,鉴定了6个关键的候选基因,其中一些候选基因与生物量积累有关。综上,长角果数量的自然变化在很大程度上受到生物量和营养积累的影响,这基本上反映了源与汇之间的正调节关系。作者的研究为油菜中角果数的自然变化提供了一个全面而系统的解释,这为油菜角果数量的提高奠定理论基础。
A systematic dissection of the mechanisms underlying the naturalvariation of silique number in rapeseed (Brassica napus L.) germplasm[J]. PlantBiotechnology Journal, 2019, 18(2).