热搜词:宏基因组测序 芯片检测

发布时间:2020-09-07 15:00:00 点击数:次
近日,博越致和客户海南医学院第一附属医院卢惠医生团队在国际期刊《Bioscience Reports》(IF=2.942)上发表题为“RNA-sequencing and bioinformatics analysis of long noncoding RNAs and mRNAs in the asthenozoospermia”的研究文章。文章中精浆外泌体分离、鉴定、全转录组测序、数据分析、文章作图等技术由武汉博越致和生物科技有限公司提供。

研究背景
不孕症是一个全球性的健康问题,约有15%的育龄夫妇受到影响,而男性因素导致不育症占50%。弱精子症是人类男性不育的主要原因之一。长非编码RNA(lncRNA)在精子发生过程中起关键作用。外泌体是纳米级的细胞外囊泡(40-180 nm),几乎可以由所有类型的细胞释放,并稳定存在于各种体液(例如血液,尿液,唾液,精液和卵泡)中。外泌体的重要性在于它们通过传递生物活性分子(包括蛋白质,DNA,mRNA和非编码RNA)在细胞间通讯中的作用。lncRNA在表观遗传调控,转录调控和转录后调控水平中以RNA形式调控基因表达。据报道,lncRNA的调节和结构功能在广泛的生物过程中起着关键作用,而lncRNA的无序调节导致多种人类疾病。据报道正常人和弱精症人精子中lncRNAs的表达谱和特征,表明lncRNAs表达与精子活力之间存在关联。但是,lncRNA在正常和弱精子症的精浆外泌体中的表达和特征尚未得到解决。因此,为了研究与弱精子症相关的复杂调控网络,作者进行了RNA测序并分析了正常和弱精症组之间差异表达的基因(DEG),差异表达的lncRNA(DElncRNA)和差异表达的信使RNA(DEmRNA)和新的lncRNA。构建了lncRNA–miRNA–mRNA的共表达网络,提供了一组关键的lncRNAs,用于未来对弱精子症的分子机制的研究。
研究结果
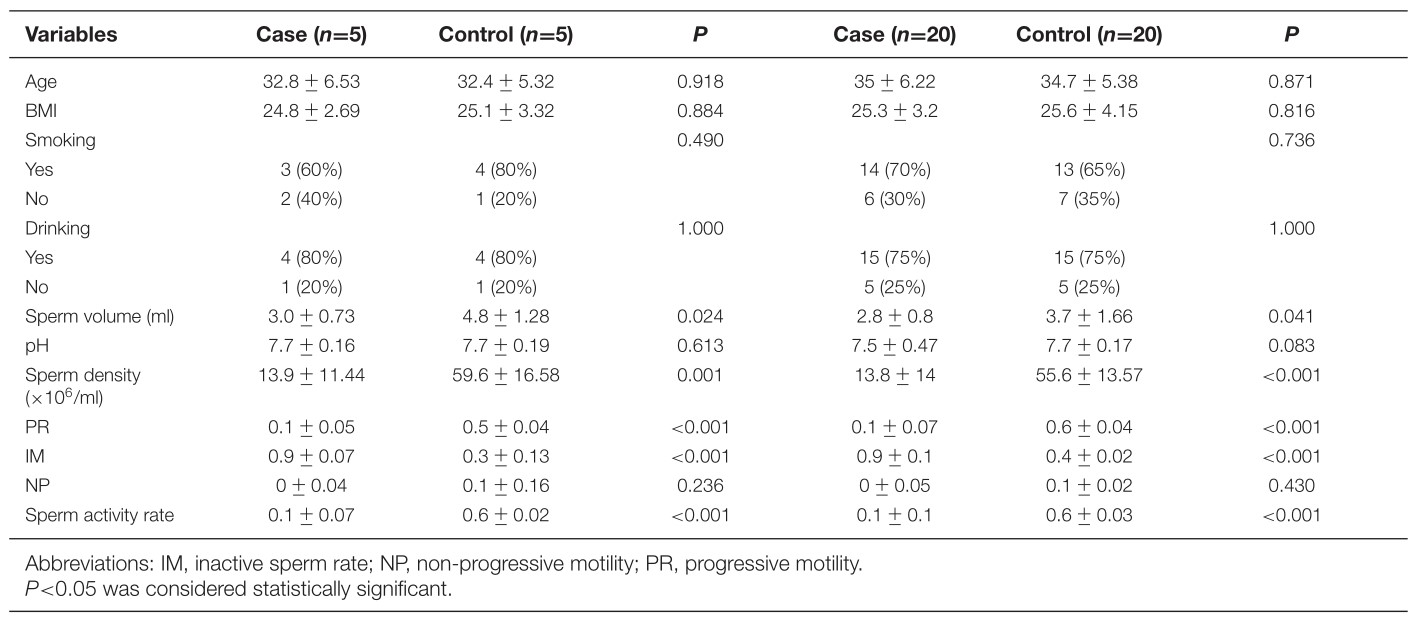
表1总结了病例和正常组的基本特征和精子参数。病例对照研究共招募了50名志愿者,包括25名患者(平均年龄±标准差(SD):32.8±6.53和35.0±6.22)和25个正常组(平均年龄±SD:32.4±5.32和34.7±5.38)。病例组与正常组在年龄,BMI,吸烟和饮酒分布方面无统计学差异(P>0.05)。病例组和对照组的精子参数,包括精子体积,精子密度,PR,IM和精子活动率均存在显着差异(P>0.05)。
表1 病例和对照的基本特征和精子参数
人类精浆中外泌体的特征如图1所示。透射电子显微镜观察结果显示,正常和弱精子症男性的囊泡显示出相似的形状和大小,囊泡的范围从50到150nm,它们中大部分在两组中均小于100nm(图1A,B)。为了进一步检测囊泡表征,作者使用了蛋白质印迹法来检测外泌体特异性抗原分子CD63和CD81(图1C)。分析结果表明,所有样品均表达了这些标志物,正常和弱精子症组的总蛋白质含量没有显着差异。
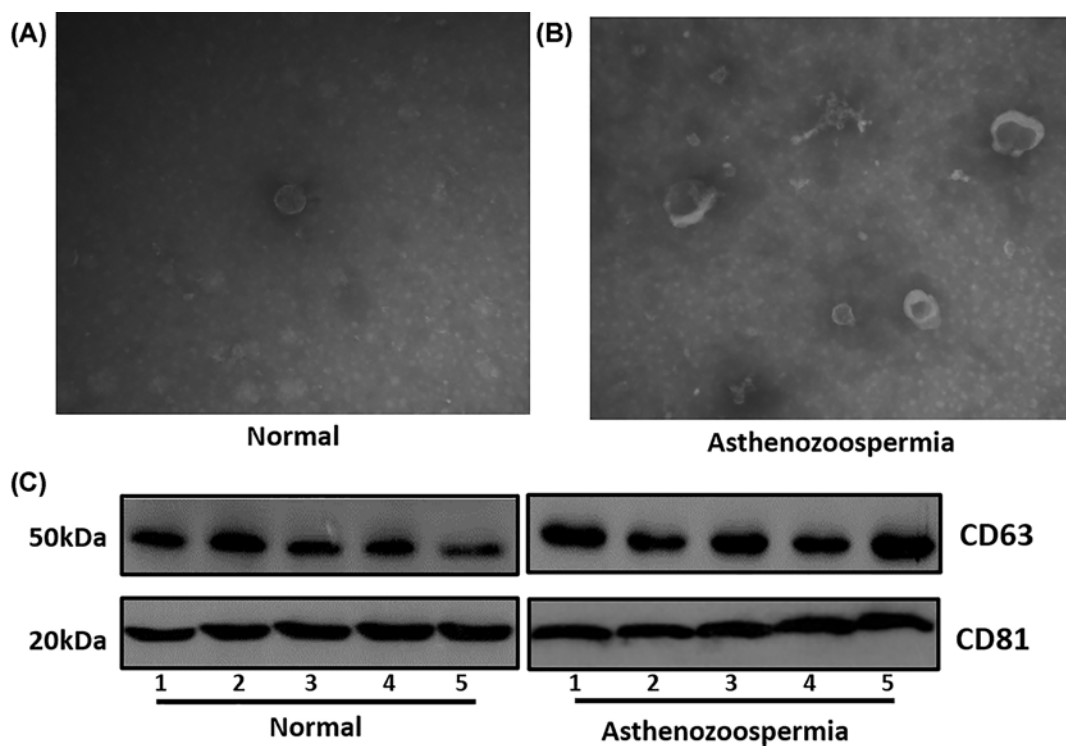
图1 精浆血浆外泌体的表征
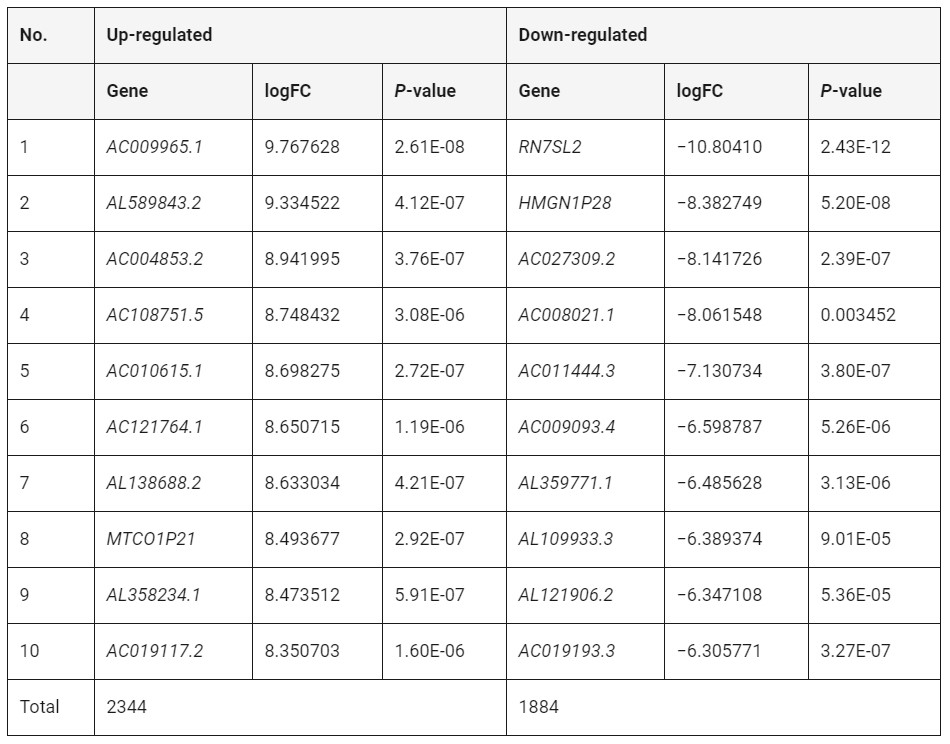
使用R软件DESeq2软件包分析了弱精子症和正常人群之间基因表达水平的差异。通过|log2FC|获得,与正常组相比,弱精子症患者总共获得了4228个显着的DEG,其中包含2344个上调的DEG和1884个下调的DEG。表2显示了前10个显着上调的DEGs(弱精子症vs正常组)。图2A,B显示了弱精子症和正常组之间的DEGs的火山图和热图。
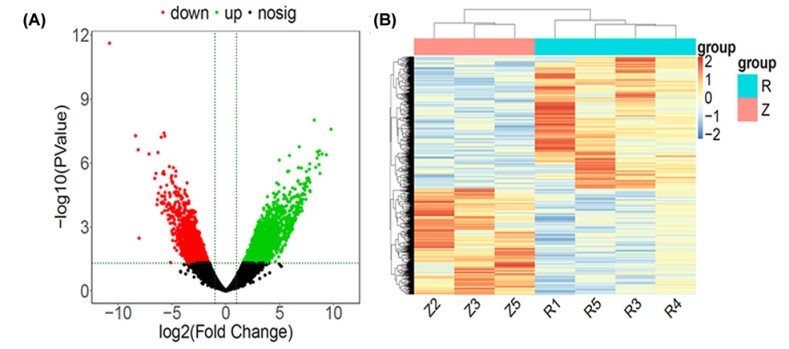
图2 弱精子症不育症与正常人群之间差异表达的基因
表2 弱精子症和正常人之间差异表达的基因(top10)
为了探索这些DEG的潜在功能,分别对下调和上调的DEG进行了GO和KEGG途径以及DO富集分析。通过对DEG的GO分析,发现上调的DEG富集到top5的GO term:蛋白质定位到内质网,蛋白质定位到膜核糖体(BP),核糖体和核糖体亚基(CC),通道活性和跨膜转运蛋白活性(MF)(图3A);下调的DEG富集到top5的GO term:核分裂和细胞器裂变(BP),侧向元素和P颗粒(CC)以及核酸酶活性和维生素结合(MF)(图3B)。KEGG通路分析显示,top10的KEGG通路中,DEG的上调主要与核糖体,转录失调,酒精中毒,可卡因成瘾和肥大症有关(图3C)。此外,根据KEGG通路分析(图3D),下调的DEG表现出与炎症和代谢通路的强烈关联。通过DO分析,我们发现在癌症中,DEG的上调显着富集(图3E),而DEG的下调与生殖系统疾病,视网膜变性和真菌病有关(top10的DO)(图3F)。
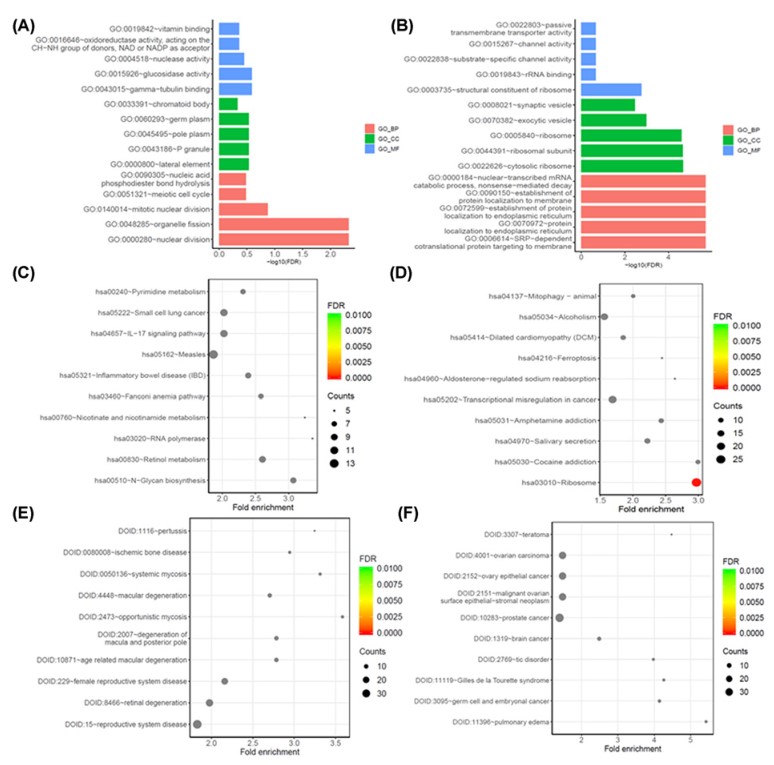
图3 差异表达基因的富集分析
作者从获得的RNA测序数据中比较弱精症组和正常组的lncRNA和mRNA表达水平。与正常对照组相比,弱精症患者总共获得995个DE lncRNA,包括656个上调的lncRNA和339个下调的lncRNA。表3显示了top 10显著上调的DE lncRNAs和top 10显著下调的DE lncRNAs。弱精子症和正常组之间的DElncRNA聚类分析的火山图和热图分别显示在图4A,B中。为了研究可能的lncRNA-mRNA相互作用,我们进行了RNA测序分析并揭示了弱精子症和正常对照之间的2338个DEmRNA。其中,弱精子症组中有1128个mRNA上调,而下精子症组有1210个mRNA下调。表3显示了前10个上调程度最高的DEmRNAs(无精子症vs正常值)。图4C,D分别显示了弱精子症和正常人之间DEmRNA聚类分析的火山图和热图。此外,与正常组相比,弱精子症患者中发现11706种新的DElncRNA(4321上调和7385下调)(图4E,F)。
表3 上调和下调DEG的DO富集分析(top 10)
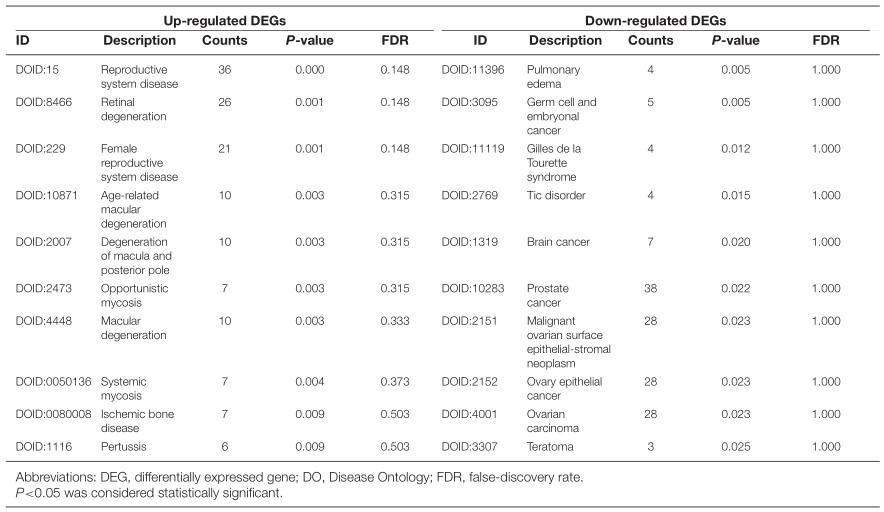
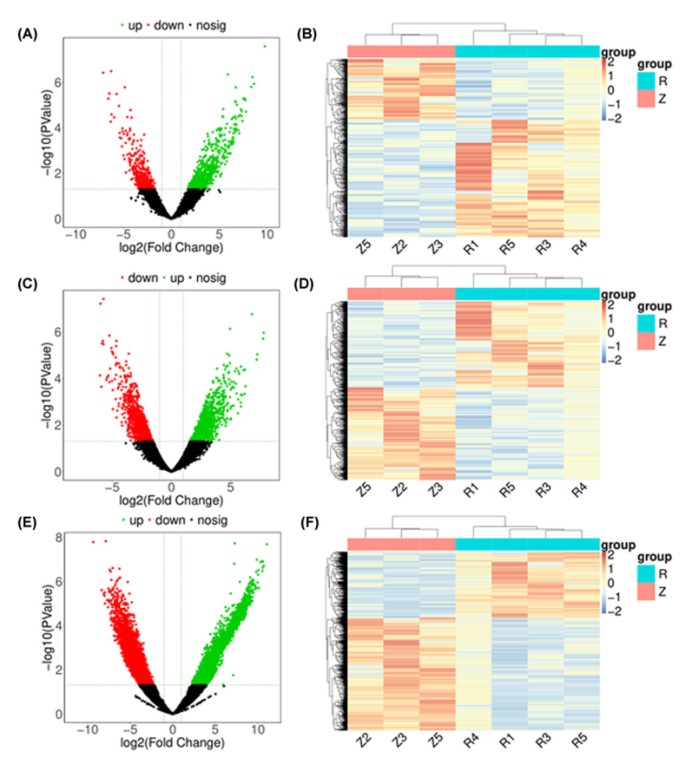
图4 弱精症不育症人群与正常人群lncRNA和mRNA的差异表达
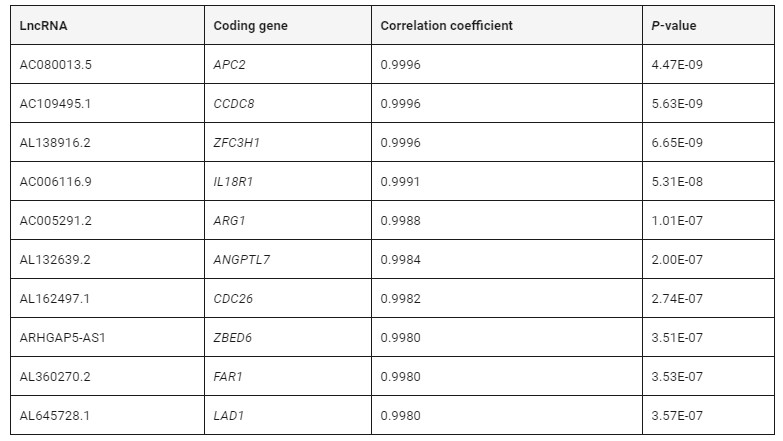
为了鉴定DElncRNA和DEmRNA之间的相关性,我们进行了Pearson相关性测试以计算lncRNA和mRNA之间的相关系数。相关系数大于0.8且P值小于0.05定义为共表达DElncRNA–DEmRNA对。我们发现254,981个正相关的DElncRNA–DEmRNA对。表4显示了DElncRNA–DEmRNA对的前10个正相关。
表4 DE LncRNA和mRNA的关联分析(top 10)
LncRNA通过顺式作用元件和反式作用因子对蛋白质编码基因起作用。在本研究中,探讨DElncRNAs如何改变精子功能。我们预测了弱精症和正常对照组之间DE lncRNAs的顺式和反式调节靶基因。筛选最接近其上游和下游100 kb的lncRNA的编码基因,并使用Bedtools程序分析它们与lncRNA的关联。七个顺式调节的相关对lncRNA–mRNA(IGF2-AS/IGF2,AL139353.2/HEATR5A,AC003102.1/UBTF,AC010247.2/POU2F2,AC005034.3/MRPL19,AL031666.2/ZMYND8和AFAP1-AS1/AFAP1),如表8和图5所示。
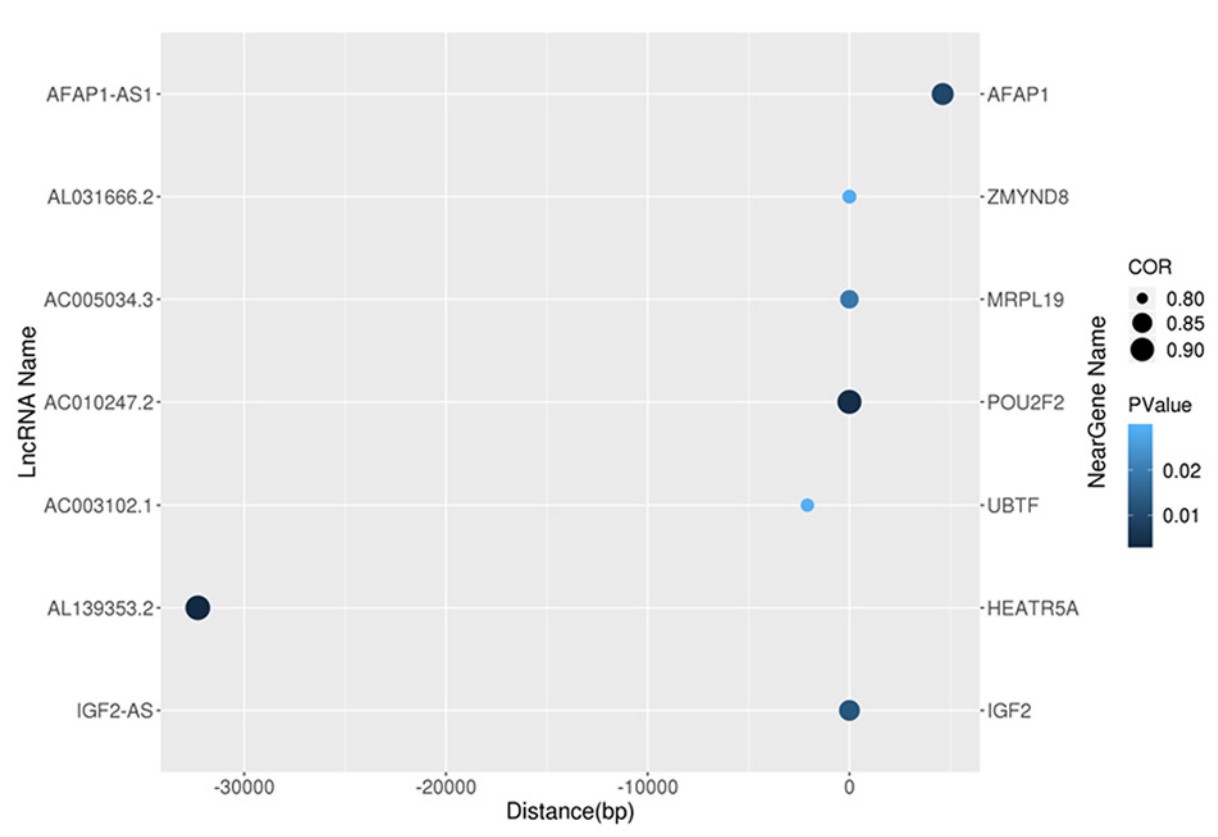
图5 DE lncRNA与顺式调控的靶基因的关联
我们在starBase数据库中使用DElncRNA–DEmRNA共表达数据与miRNA靶标关系信息相结合来执行超几何分布测试,以构建lncRNA–miRNA–mRNA调控网络(图6)相互作用网络包括11个lncRNA(LINC00893,AC005034.3,COX10-AS1,MIR497HG,LINC00894,AC015813.1,AP000424.1,MIR17HG,LINC00667,LINC00662和SNHG3),35个miRNA和59个mRNA。
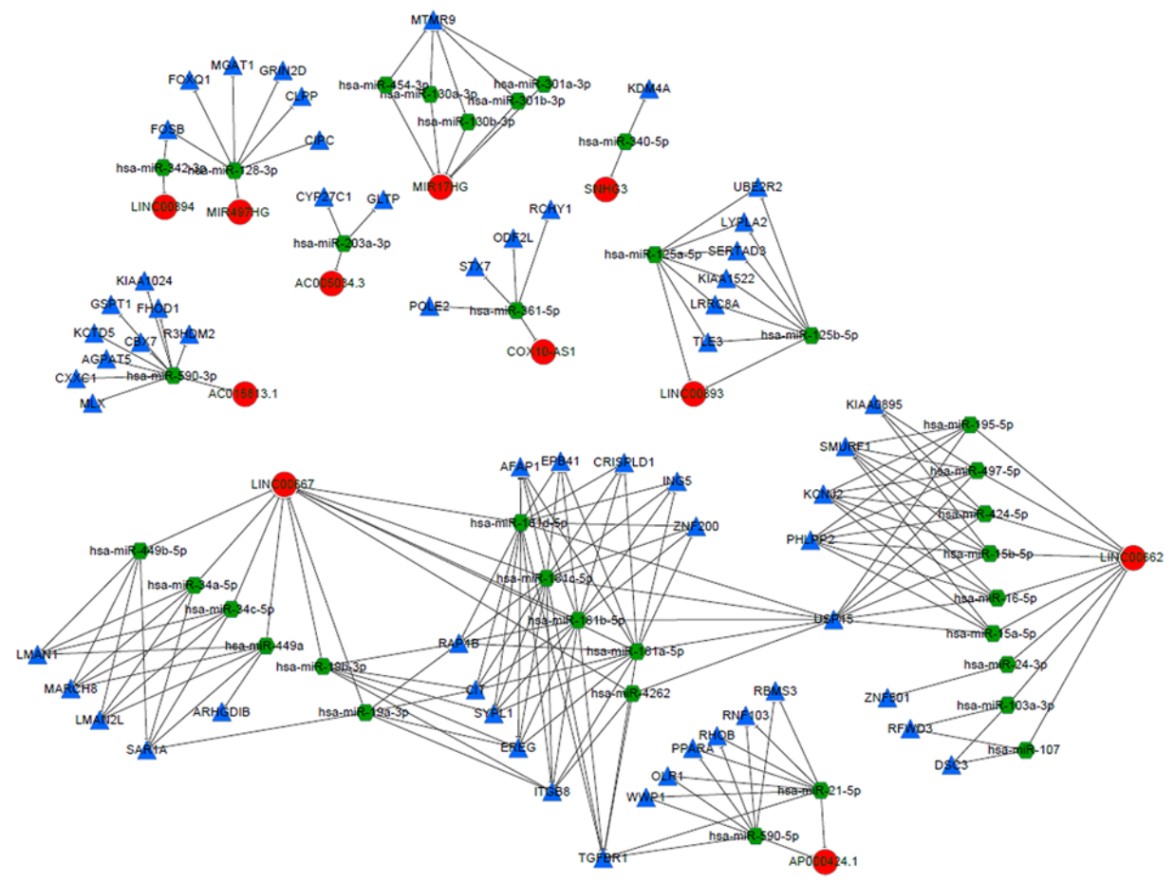
图6 lncRNA–miRNA–mRNA调控网络
为了证实测序和生物信息学结果,选择了弱精子症组中的两个上调(LINC00667和COX10-AS1)和三个下调(LINC00893,MIR497HG和IGF2-AS)lncRNA用于qRT-PCR。与测序结果一致,在弱精症组中发现所有五个lncRNA与正常人相比差异表达(P<0.05;图7)。
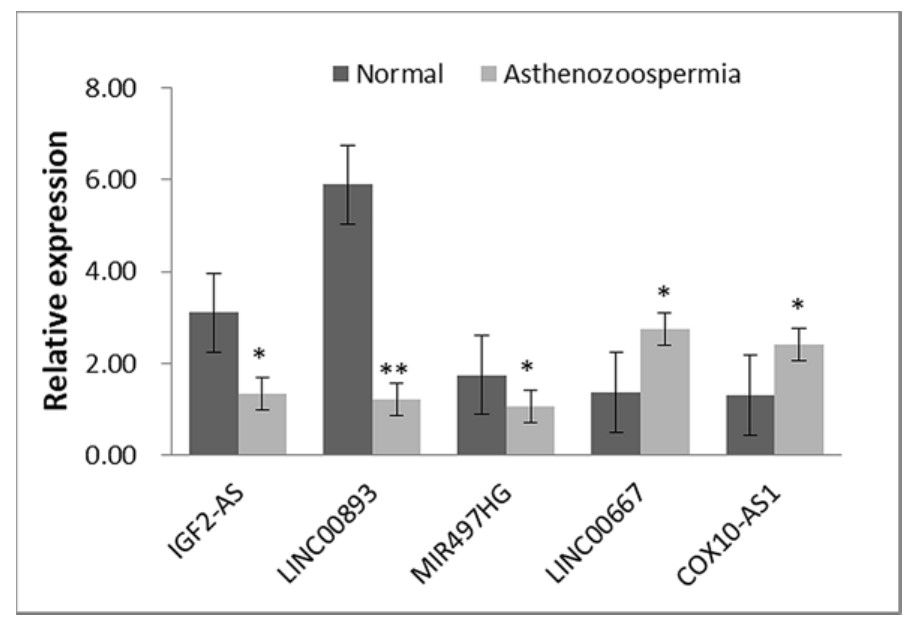
图7 qRT-PCR分析弱精症和正常人群中5种lncRNA的表达(*P<0.05;**P<0.001)
研究结论
作者确定了弱精症和正常人之间的关键DE lncRNA和DE mRNA以及DEgenes的潜在功能。数据提供了可能与弱精症的病理机制有关的基因和途径的生物信息学分析。此外,qRT-PCR分析证实了我们的测序结果。研究中构建了弱精子症的lncRNA–mRNA–miRNA调控网络。因此,研究结果提供了一组关键的lncRNAs,用于未来对弱精子症的分子机制的研究。
原文链接: https://portlandpress.com/bioscirep/article/40/7/BSR20194041/225687/RNA-sequencing-and-bioinformatics-analysis-of-long?searchresult=1