热搜词:宏基因组测序 芯片检测

发布时间:2021-09-03 10:00:00 点击数:次
外泌体(Exosome)是一种直径约30-150nm的双层膜囊泡状结构小体,大部分的动物细胞都可以分泌外泌体,如免疫细胞、干细胞、心血管细胞、网织红细胞、血小板、神经细胞和肿瘤细胞等。外泌体广泛分布于外周血、尿液、唾液、乳汁、腹水、羊水、胸腔积液、腹腔积液等体液中。当其由宿主细胞被分泌到受体细胞中时,外泌体可通过其携带的蛋白质、核酸、脂类等来调节受体细胞的生物学活性。外泌体在抗原呈递、肿瘤的生长与迁移、组织损伤的修复等方面起着重要的作用。由于外泌体的特殊结构和功能,使得它具有潜在的应用价值,一方面可以作为诊断多种疾病的生物指标,另一方面也可以作为治疗手段,未来有可能作为药物的天然载体用于临床治疗。
血浆来源的外泌体miR-15a-5p作为早期检测子宫内膜癌的诊断生物标志物
题目:Plasma-derived exosomal miR-15a-5p as a promising diagnostic biomarker for early detection of endometrial carcinoma
期刊:Mol Cancer
影响因子:15.302
发表时间:2021.03
摘要:子宫内膜癌(EC)是妇科恶性肿瘤的主要死亡原因之一。为了改善对患者EC的早期检测,作者进行了大量血浆来源的外泌体miRNA研究,以发现EC中的诊断性生物标志物。在来自健康受试者和EC患者的56份血浆样本中,进行小RNA测序,鉴定候选外泌体miRNA作为诊断生物标志物。这些候选miRNA通过ddPCR在202个独立血浆样品中进行进一步验证,通过实时定量PCR(qRT-PCR)在32对子宫内膜肿瘤和邻近正常组织中进行了验证,使用ddPCR在手术前后分别对12名患者的血浆样品进行了匹配。与健康受试者相比,从EC患者血浆样本中分离的外显子组中,miR-15a-5p、miR-106b-5p和miR107显著上调。尤其是单独使用miR-15a-5p产生的AUC值为0.813,可将I期EC患者与健康受试者区分开来。miR-15a-5p与血清肿瘤标志物(CEA和CA125)的整合达到了0.899的更高AUC值。miR-15a-5p与EC患者的临床表现之间也存在密切联系。其外泌体表达不仅与EC的肌层浸润深度和侵袭性有关,还与TTE和DHEAS等生殖激素水平有关。总而言之,血浆来源的外泌体miR-15a-5p是检测早期子宫内膜癌的一种有前途且有效的诊断生物标志物。
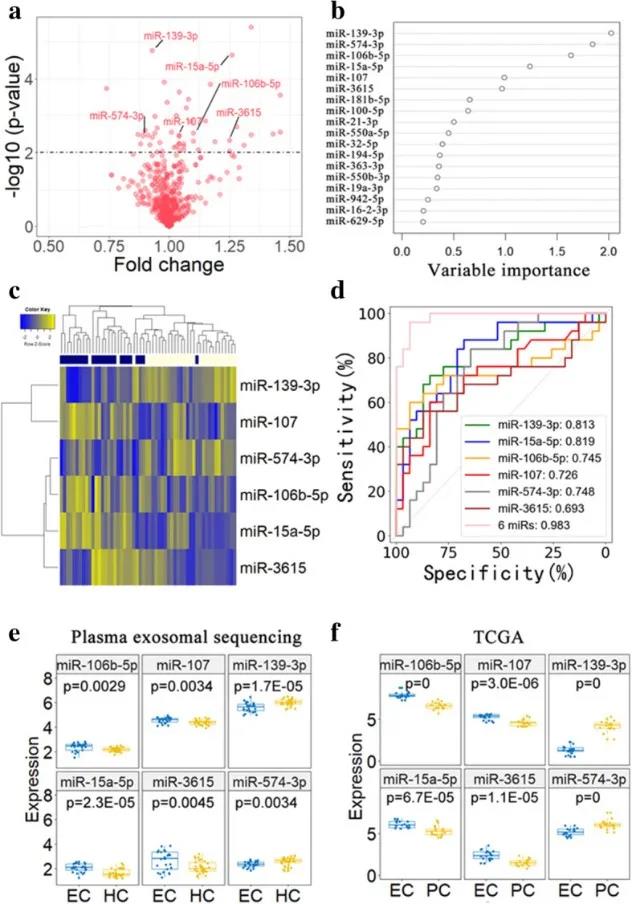
EC患者血浆外泌体中miRNA的异常调节
缺氧肿瘤来源的外泌体miR-31-5p通过负调SATB2逆转EMT和激活MEK/ERK信号促进肺腺癌转移
题目:Hypoxic tumor-derived exosomal miR-31-5p promotes lung adenocarcinoma metastasis by negatively regulating SATB2-reversed EMT and activating MEK/ERK signaling
期刊:J Exp Clin Cancer Res
影响因子:11.161
发表日期:2021.6
摘要:外泌体已经成为细胞间通讯的重要媒介。缺氧被广泛认为是肿瘤侵袭性的关键调节因子,并显著影响肿瘤细胞的外泌体释放。然而,人们对来自低氧肺腺癌(LUAD)细胞的外泌体的作用知之甚少。对从缺氧LUAD细胞衍生外泌体 (HExo) 和常氧LUAD细胞衍生外泌体 (NExo) 中分离的miRNA样品进行测序,以鉴定可能介导肿瘤进展的miRNA。将外泌体miRNA与LUAD细胞共培养,以评估其在体外和体内对细胞迁移和转移的生物学影响。通过双荧光素酶测定证实了外泌体miRNA的细胞靶标。蛋白质印迹研究表明外泌体miRNA调节相关通路。还评估了来自血浆的循环外泌体miRNA的可用性。研究发现低氧LUAD细胞来源的外泌体(HExo)能显著增强常氧LUAD细胞的迁移和侵袭。miRNA测序结果显示miR-31-5p在HExo内大量内化,可被常氧LUAD细胞摄取。研究发现,外泌体miR-31-5p可直接靶向SATB2诱导的上皮间质转化,并显著增加MEK/ERK信号的激活,从而促进体外和体内肿瘤进展。此外,在LUAD患者,特别是转移性疾病患者中检测到较高水平的循环外泌体miR-31-5p。研究结果表明,外泌体miR-31-5p在LUAD进展中发挥了关键作用,可以作为LUAD的诊断生物标志物。
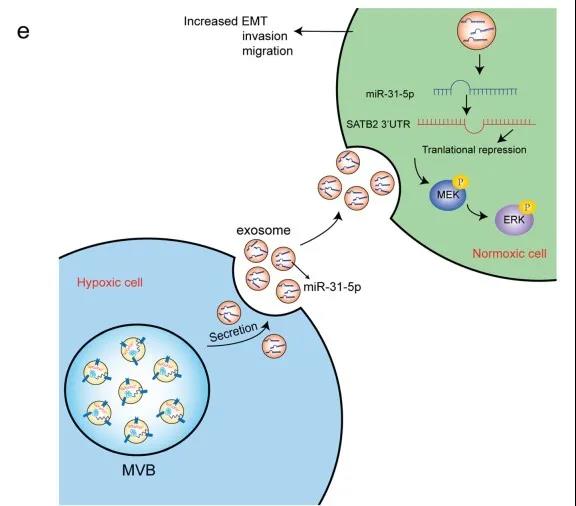
外泌体miR-31-5p通过降低SATB2表达和增加MEK/ERK通路的活性从而促进LUAD侵袭和迁移的示意图
外泌体CD44v6/C1QBP通过促进肝的纤维化微环境驱动胰腺癌肝转移
题目:Exosome-delivered CD44v6/C1QBP complex drives pancreatic cancer liver metastasis by promoting fibrotic liver microenvironment
期刊:Gut
影响因子:19.819
发表日期:2021.04
摘要:胰腺癌是全球最致命的恶性肿瘤之一,其中胰腺导管腺癌(PDAC)是最常见的类型。初诊时,超过80%的PDAC患者发现远处转移,其中肝是常见的转移器官。目前用于PDAC肝转移的治疗选择有限,有较高的死亡率。这种缺乏主要是由于对肝转移的基本机制了解不足。通过外泌体促癌的分泌蛋白质组的传递和运输对于转移前微环境的形成和迁移至关重要。这项研究旨在探讨PDAC衍生的外泌体(Pex)如何调节肝脏微环境并促进转移的潜在机制。通过尾静脉Pex注射对“C57BL/6小鼠”进行了“驯化”。脾内注射肝转移和PDAC原位移植模型用于评估肝转移。使用慢病毒转染建立了稳定的细胞系CD44v6(CD44变异同种型6)或C1QBP(补体C1q结合蛋白)敲低或过表达。使用Kaplan-Meier生存曲线和Logistic回归模型预测预后和肝转移。Pex尾静脉注射诱导肝纤维化细胞外基质的沉积,从而促进PDAC肝转移。具体而言,将外泌体CD44v6/C1QBP复合物递送至肝卫星细胞(HSC)的质膜,导致胰岛素样生长因子1信号分子的磷酸化,从而导致HSC活化和肝纤维化。PexCD44v6和C1QBP在有肝转移的PDAC患者中的表达显着高于无肝转移的PDAC患者,同时高表达外泌体CD44v6和C1QBP与更差的预后和更高的术后PDAC肝转移风险相关。Pex衍生的CD44v6/C1QBP复合物对于形成纤维化肝微环境和PDAC肝转移至关重要。高表达的外泌体CD44v6和C1QBP是有前景的生物标志物,可预测PDAC患者的预后和肝转移。
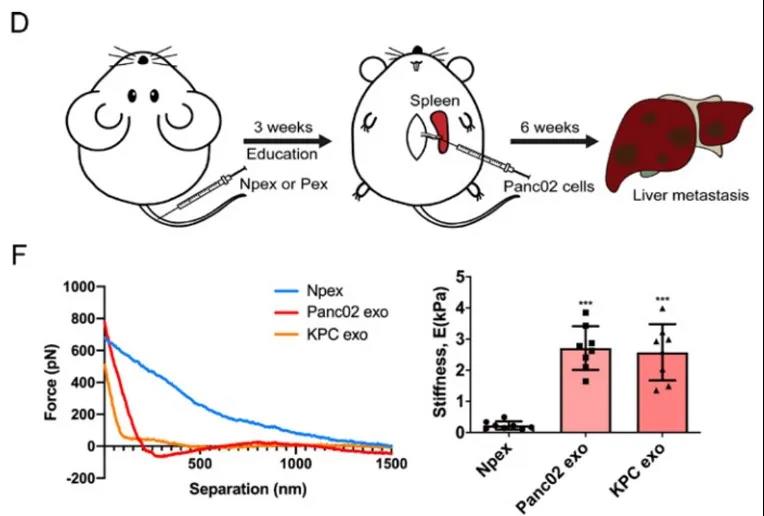
PDAC外泌体(Pex)诱发肝纤维化并促进胰腺导管腺癌(PDAC)肝转移
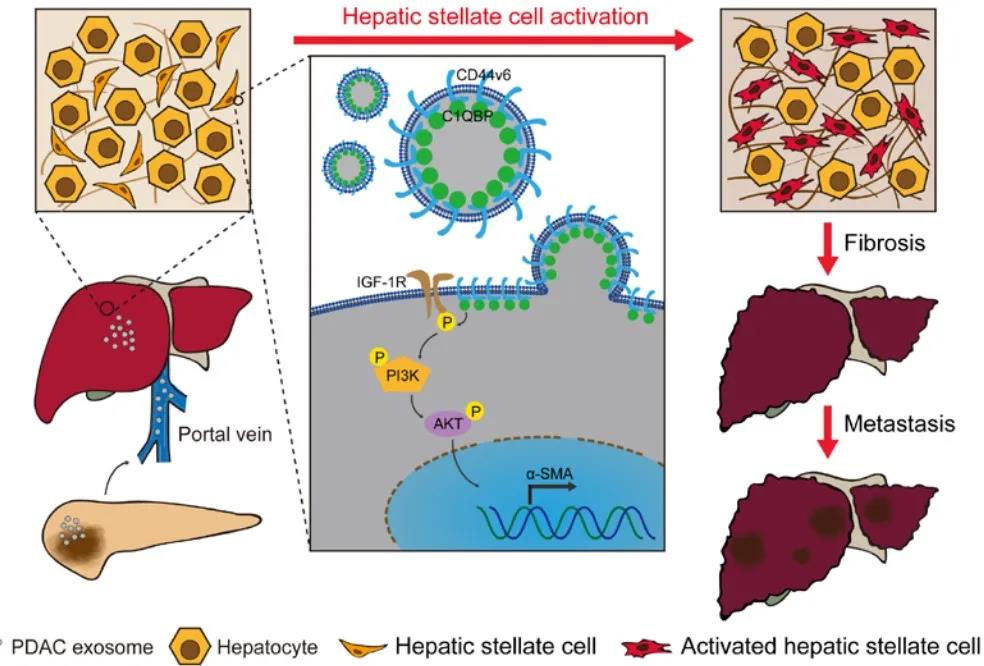
CD44v6/C1QBP促进胰腺癌肝转移模式图