基本信息
文章题目:Single-cell Ribo-seq reveals cell cycle-dependent translational pausing
期刊:Nature
影响因子:49.962
摘 要
单细胞测序方法能够深入分析多种生物体中细胞类型和细胞状态的多样性。这些工具主要侧重于对单细胞基因组、表观基因组和转录组进行测序。然而,尽管最近在单细胞分辨率下通过质谱法检测蛋白质方面取得了进展,但测量单个细胞中的翻译仍然是一项重大挑战。在现有方法的基础上,作者大大提高了这些检测的灵敏度,以实现单细胞中的核糖体分析。与机器学习方法相结合,该技术可实现单密码子分辨率。作者证明对特定氨基酸的限制导致核糖体在编码该氨基酸的密码子子集上暂停,值得注意的是,这种暂停仅在与其细胞周期状态相关的细胞亚群中观察到。作者在非限制性条件下进一步扩展了这种现象,并检测到有丝分裂期间明显的 GAA 暂停。最后,作者证明了这种技术对罕见的原代肠内分泌细胞的适用性。
研究内容
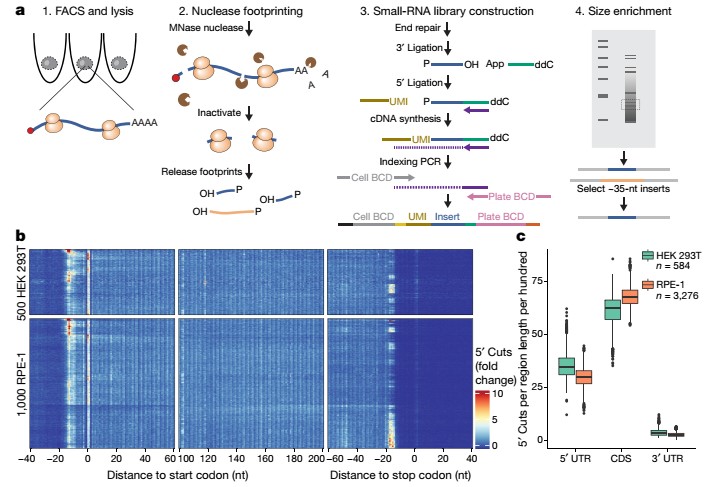
单细胞核糖体测序 (scRibo-seq) 将核酸酶足迹与小 RNA 文库构建以及片段大小富集相结合,以测量单细胞中的翻译动态(图1a)。作者将这些过程整合到一个反应体系中,发现能够显著提高现有核糖体分析技术的灵敏度和可扩展性。首先将单个活细胞分选到含有放线菌酮的裂解缓冲液中,以稳定和停止转录本上的核糖体。然后暴露的 RNA 被微球菌核酸酶 (MNase) 消化,并释放产生的核糖体保护足迹 (RPF)。通过连接包含唯一分子标识符 (UMI) 和引发位点的接头,这些足迹被转换为测序文库,用于后续的cDNA合成和PCR。最后,筛选符合典型 RPF长度的文库片段进行测序。
为了验证这种方法,作者首先使用HEK 293T和hTERT RPE-1细胞系构建了scRibo-seq文库,每个细胞可检测到3348±15个基因,10451±85个独特的reads。随后通过生物信息学分析发现,这些片段能够映射到编码序列 (coding sequences, CDSs),它们的5 ʹ末端在起始密码子上游大约15个核苷酸位置显著富集,在终止密码子上游大约18个核苷酸位置显著减少;起始密码子和终止密码子的局部密度均有增加;reads的5ʹ端沿CDS显示了一个清晰但适中的3个核苷酸的周期性。该方法能够有效的显示蛋白编码转录本的5’UTR、CDS以及3’UTR区域的核糖体分布。
图1
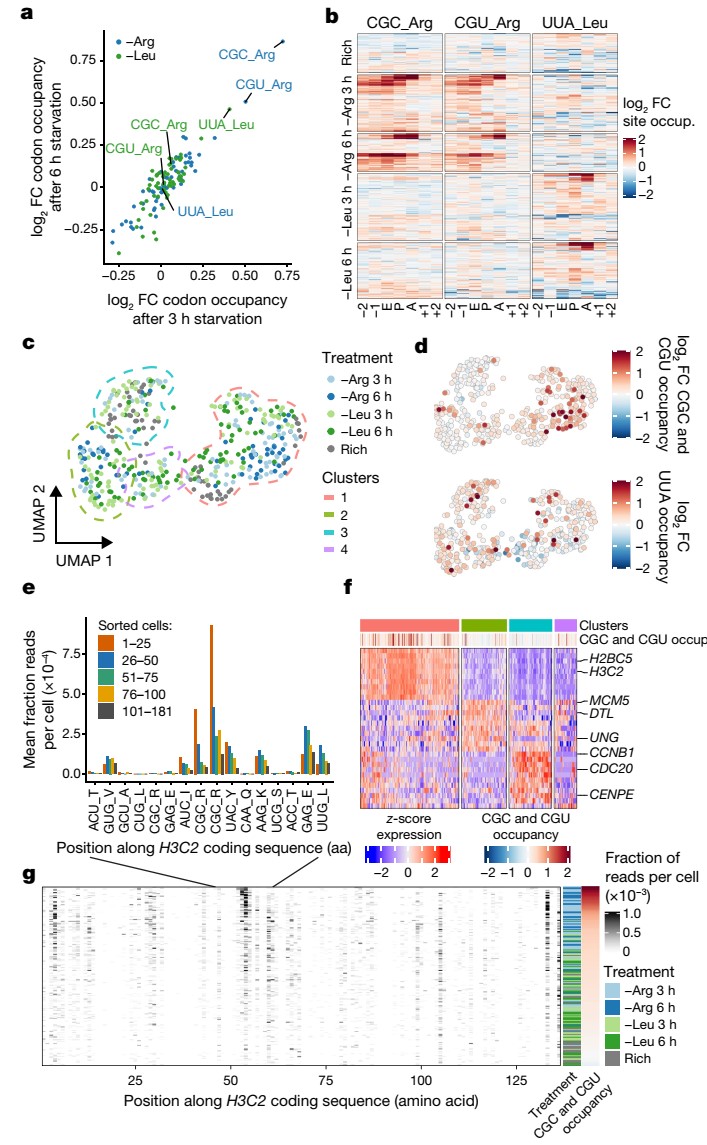
为了进一步验证scRibo-seq测量翻译动力学的能力,作者从HEK 293T培养基中去除精氨酸和亮氨酸,并在不同时间点后再进行细胞分选和检测,发现核糖体的停顿的确是不同处理依赖性的暂停。在每种限制条件下,只有一部分细胞表现出暂停反应。利用每CDS的RPF计数对细胞进行聚类,可以通过细胞周期标记基因识别出四个群体。在这些群体的基础上,作者发现细胞周期状态、氨基酸限制对翻译暂停存在显著影响。比如,精氨酸的缺失会造成CGC以及CGU密码子上足迹的频率升高,而去除培养基中的亮氨酸则不会有此现象。而UAA密码子上核糖体占位的增加则只在亮氨酸饥饿的情况下出现。因此,该结果证明
了scRibo-seq技术的准确性和有效性。
图2
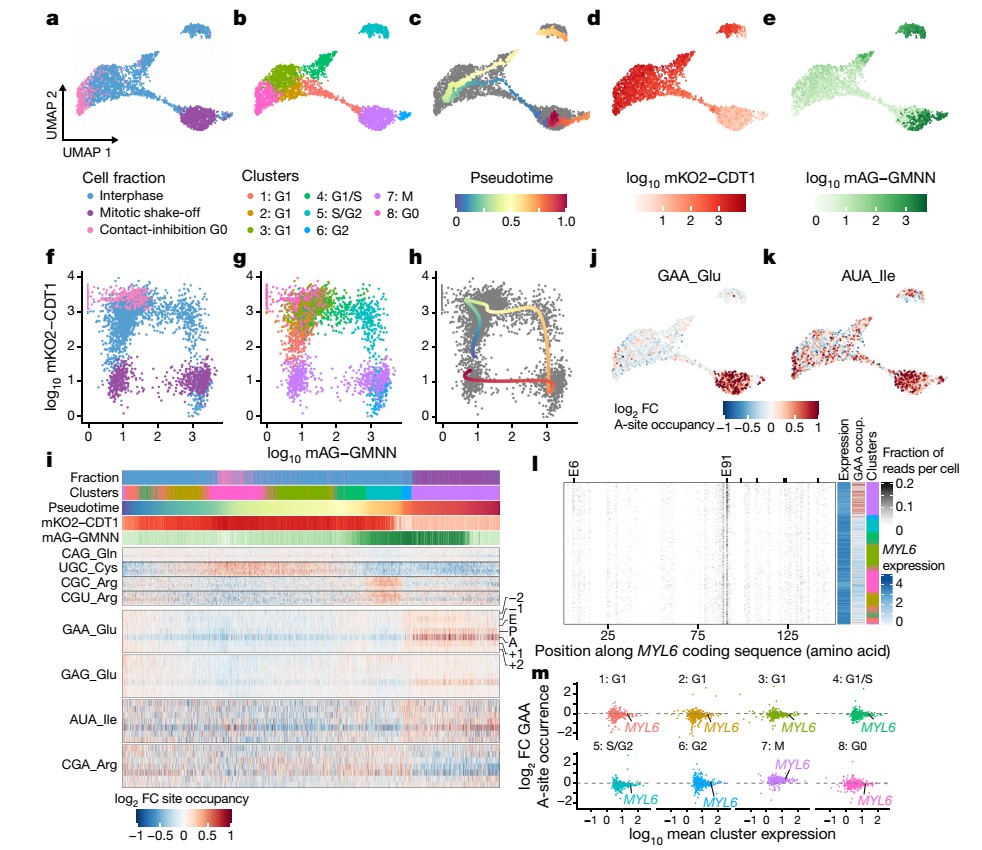
翻译调控是一种重要的细胞周期调控机制,但前期的研究仅仅粗略地解决了细胞周期的主要状态,并依赖于用同样作用于翻译机制的方法捕获或同步细胞。在观察到细胞周期状态会影响对氨基酸限制的响应后,作者检测了未受干扰的细胞周期中是否会改变翻译特性。作者将scRibo-seq技术与FUCCI(Fluorescent ubiquitination-based cell cycle indicators)技术进行联用,对不同细胞周期的细胞进行分选和收集,发现核糖体的活性位点的确受到细胞周期的显著影响。利用每CDS的RPF计数对单个细胞进行聚类,确定了8个群体。随后,通过伪时序分析进一步解决了细胞周期中的这一进程,并建立了与FUCCI标记相似的轨迹。通过深入分析,作者鉴定了1853个在翻译动态中有显著差异的基因。在细胞周期中,部分密码子出现频率变化,有丝分裂细胞中A位点占位率增加 (GAA、GAG和AUA) 或减少 (CGA) 的密码子有4个,而其他活性位点保持不变。其中,GAA 上 A 位点暂停的增加是最显著的和阶段特异性的。另外,这些A位点暂停的变化是全局的,影响大多数翻译的基因。通过比较每个群体和背景之间RPFA位点GAA密码子的基因频率,作者发现大多数基因在有丝分裂期间都经历了GAA暂停的增加。这些A位点暂停的阶段性变化可能反映了有丝分裂期间翻译伸长动力学的全局变化。
通过scRibo-seq检测,作者根据已经建立的激素细胞标记物基因的翻译特征鉴定发现了8个细胞类型,并对EECs细胞中的密码子特异性核糖体停顿进行了鉴定。该结果说明scRibo-seq可以直接应用于原代细胞样品,并对稀有细胞群的翻译动力学过程进行测量。
图3
该研究表明scRibo-seq在测量单细胞尺度下翻译状态的可行性,填补了目前单细胞基因组学方法的关键空白。另外,scRibo-seq技术不依赖于标记物以及转基因体系,可以直接对核糖体谱进行分析,其灵敏度和分辨率相较于先前的方法都更胜一筹。这些独特的优势使我们能够详细检查哺乳动物细胞周期期间的翻译,提供支持有丝分裂期间翻译调节广泛变化的证据。未来,该技术将会得到进一步广泛的应用,可以用于揭开高度动态系统中罕见细胞群的转录特征。